Fagozito
Fagozitoak odolean, linfan eta ehunetan dauden eta fagozitosia egiten duten zelulak dira, mikrobioak eta partikula arrotzak irentsi eta indargabetzen dituztenak. Odoleko eta ehunetako "garbiketa-sistema" osatzen dute, immunitate-sistemaren funtsezko elementuak izanik. Horretarako, fagozitoek ondoz ondoko urrtasak egiten dituzte: zelulak infekzio-guneetara erakarri, mikrobioen bidezko ezagutza eta aktibazioa, mikrobioen fagozitosi bidezko irenstea, eta fagozitatutako mikrobioen suntsipena. Are gehiago, fagozitoek beste zelulekin komunikatzeko gaitasuna dute, immunitate-erantzuna indartu edo erregulatzeko; horretarako, bi mekanismo dituzte: ukipen zuzenaren bidezko komunikazioa eta zitokinen jariapenaren bidezko komunikazioa.[1]
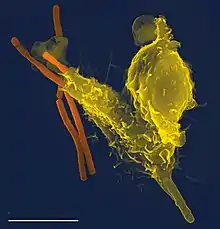
Animalia guztietan aurkitzen dira, baina ornodunetan dute garapen handiena, giza odolak 6.000 milioi fagozito baititu litroko. Gai arrotzak suntsitzeaz gain, fagozitoek hildako zelulak eta zelula-hondarrak ere fagozitatzen dituzte, garbiketa-prozesuetan hori ere baita oso eginkizun garrantzitsua.
Fagozitoak profesionalak edo ez-profesionalak izan daitezke, egiten duten fagozitosiaren eraginkortasunaren arabera. Fagozito profesionalen artean, hainbat globulu zuri daude, esaterako: neutrofiloak, monozitoak, makrofagoak, mastozitoak eta zelula dendritikoak. Fagozito profesionalen eta ez-profesionalen arteko desberdintasun nabariena da fagozito profesionalek elementu kaltegarriak detektatzeko gai diren hartzaileak dituztela.[2]
Esan bezala, fagozitoak immunitate-sisteman parte hartzen duten zelulak dira. Immunitate-sistemaren barnean modu independentean jarduten duten bi sistema bereiz daitezke: berezko immunitate-sistema eta immunitate-sistema adaptatiboa. Haien arteko ezberdintasun nagusiak erantzuteko behar duten denbora eta zehaztasuna dira. Berezko immunitate-sistemak azkarrago erantzuten du, baina ez da oso espezifikoa patogenoekiko; patogenoetan aurkitzen diren kontserbatutako sekuentziak ezagutzen dituzte zelulek, patroiak. Sekuentzia kontserbatuei PAMP deritze, patogenoei asoziaturiko patroi molekulak, alegia. Immunitate-sistema adaptatiboaren kasuan, ordea, erantzuna askoz ere motelagoa da baina zehaztasun osoz jarduten du. Fagozitoek berezko immunitate-sisteman parte hartzen dute.[1]
Infekzio-egoeretan fagozitoak patogenoa dagoen gunera erakarriak dira seinale kimikoen bidez. Seinale horien jatorria patogeno berean edo patogenoa ezagutu duten beste fagozitoetan egon daiteke. Fagozitoek egiten duten migrazioari kimiotaxi deritzo. Kimiotaxiari esker, patogenoa dagoen gunera heldu eta fagozitoaren mintzeko hartzaileak horietara lotzen dira. Prozesu horrek patogenoaren fagozitosia eragiten du.[3] Fagozitosia gertatu ostean, makrofagoek eta zelula dendritikoek ere antigenoa aurkezteko gaitasuna dute. Antigeno-aurkezpena deritzon prozesuan fagozitoak irentsitako gaiaren atalak zelula-azalera mugitzen ditu. Horrela, antigenoak immunitate-sistemako beste zeluletara aurkezten zaizkie. Horren ostean, fagozitoak gongoil linfatikoetara doaz eta materiala linfozitoei aurkezten diete. Azaldutako prozesua garrantzitsua da immunitatea garatzeko; hori dela eta, patogeno askok fagozitoen erasoetatik babesteko metodoak garatu dituzte.[4]
Historia

Ilya Ilyich Mechnikov (1845-1916) zoologo errusiarrak zelula-mota berri bat aurkitu zuen 1880ko hamarkadan. Zelula-mota hori ez zuen bere ezaugarri fisiologikoen arabera definitu, bere funtzioagatik baizik (“fagozitosia”, hain zuzen ere). Mechnikov zelula fagozitatzaileen ezaugarri gakoak ere deskribatu zituen, hala nola, beste bizidunetan barneratzeko prozesua, barneratutako partikulen deuseztapena eta bakuolo-azidifikazioa. Hori guztia dela eta, Mechnikov fagozito-biologiaren sortzailetzat hartzen da.[5]
1908. urtean, Mechnikov-ek Fisiologia eta Medikuntzako Nobel Saria jaso zuen Paul Ehrlich medikuarekin batera, immunologiaren alorrean egindako lanengatik.
Fagozito motak
Gizakien eta beste ornodun askoren fagozitoak bi taldetan sailkatzen dira: profesionalak eta ez-profesionalak. Fagozito profesionalek fagozitosia dute funtzio nagusi. Fagozito ez-profesional deritze fagozitatzeko gaitasuna duten baina hori funtzio nagusi ez duten zelulei.
Fagozito profesionalak
Fagozito profesionalek patogenoak ezagutzeko hartzaile espezifikoak dituzte, hori baita haien funtzio nagusia.[2]
Fagozito profesionalek sistema erretikulu-endoteliala osatzen dute. Sistema horrek batasun funtzionala du, baina gorputzean zehar sakabanaturik dagoenez, ez du batasun anatomikorik. Zeregin oso garrantzitsua betetzen du erantzun immunean. Fagozitoak ez daude organo jakin batean, gorputzean zehar mugitzen baitira mugimendu ameboidearen bidez. Zitokina izeneko molekulak ekoizten dituzte, immunitate-sistemaren zelulen arteko koordinazioan parte hartzen dutenak.
Fagozito guztiek dituzte lisosoma ugari, partikula arrotzen digestio-prozesuetarako entzima hidrolitikoak askatzen dituztenak. Partikula arrotza irensten dutenean, fagozitoaren barnean fagolisosoma izeneko inklusioa sortzen da, eta bertan digeritzen dira fagozitaturiko partikulak. Zenbait fagozitok oxigenoaren konposatu toxikoak erabiltzen dituzte patogenoak akabatzeko; horietako batzuk hidrogeno peroxidoa eta hidroxil erradikalak dira. Oxigeno-produktu horiek erreakzio biokimikoetan sortzen dira eta ez diote kalterik egiten fagozitoari.
Fisiologia
Fagozitoek, makrofagoek bereziki, aktibitate maila ezberdina izan dezakete. Izan ere, patogeno eta substantzia ezberdinen aurrean aktibatu eta, infekzio-gunera migratzen dute.
Aktibazioa
Makrofagoak ehunetan daudenean nahiko inaktibo mantentzen direla esan genezake, izan ere, horietan hildako zelulak eta infekzio-arriskurik ez dakarten arrastoak garbitu eta oso gutxitan parte hartzen dute antigenoen aurkezpen-prozesuan. Nolanahi ere, infekzio bat gertatzen denean, seinale kimikoek (normalean gamma interferona) haien aktibazioa eragiten dute. Makrofagoak aktibatzen direnean, MHC II hartzaileak adierazten dituzte; horrela, antigenoen aurkezpena egiteko prest daude. Egoera horretan daudenean, patogenoak suntsitzeaz gain, antigenoen aurkezpena ere egiten dute makrofagoek. Hala ere, zuzenean patogenotik seinaleren bat jasotzen dutenean, haien "hiperaktibazioa" gertatzen da; orduan, proliferatzeari utzi eta soilik patogenoen hilketaz arduratuko dira. Kasu horretan, makrofagoek fagozitatzeko duten ahalmena handiagotzen da, azkartasuna emendatu eta, gainera, partikula handiagoak fagozita ditzateke. Protozooen tamainako gaiak fagozitatzera hel daitezkeela ikusi da.[6]
Neutrofiloak inaktiboak dira odolean daudenean. Dena dela, oso azkar mugitzen dira. Makrofagoek jariatutako seinaleak heltzen zaizkienean gelditu, eta odoletik ateratzen dira. Ehunetan bidaiatu ahala, zitokinak jaso eta aktibazioa gertatzen da. Horrela, infekzio-gunera heltzen direnerako, jada aktibatuta eta jarduteko prest daude.[6]
Migrazioa
Infekzioa gertatzen denean, "SOS" seinaleak askatzen dira makrofagoak infekzio-gunera erakartzeko. Seinale kimiko horiek honakoak izan daitezke: infektatutako bakterioaren proteinak, koagulaziorako peptidoen produktuak, konplementu-proteinak edo infektatutako ehunean kokatzen diren makrofagoek askatutako zitokinak.[4] Are gehiago, zitokinek odoleko neutrofiloak eta monozitoak infekzio-gunera erakartzen dituzte.[7]
Esan bezala, infekzio-gunera heldu ahal izateko, fagozitoak odol-hodietatik ateratzen dira eta ehunetan zehar abiatzen dira. Infekzio-seinaleek eragiten dute odol-hodiak ainguratzen dituzten endotelio-zelulek selektina proteina adieraztea. Neutrofiloek horietara lotzeko gaitasuna izango dutenez, eragina izaten dute migrazioan. Are gehiago, beste seinale batzuk jariatzen dira, hodi-zabaltzaileak izango direnak. Zelula endotelialen arteko lotura ahultzen dutenez, fagozitoei irteera errazten zaie. Horrek zelula endotelialen arteko lotura hainbestekoa ez izatea eragiten du. Horrela, fagozitoei irteera errazten zaie.[4]
Migrazioan eragina duen efektu garrantzitsu bat kimiotaxia da. Kimiotaxia gertatzen denean, zelulak seinalearen kontzentrazio gutxieneko gunetik kontzentrazio handieneko gunera erakarriak dira.[4] Neutrofiloak, adibidez, ehunetan zehar doaz infekzio-gunera heldu arte, eta, nahiz eta prozesu hori oso garrantzitsua izan infekzioen aurka egiteko, migrazioak gaixotasunaren antzeko sintomak eragin ditzake.[8] Infektatutako milioika neutrofiloek migrazioa egiten dute; hala ere, egun batzuen buruan hiltzen dira. [6]
Monozitoak

Monozitoak hezur-muinean garatzen hasten dira eta haien heltze-prozesua odolean bukatzen dute. Monozito helduek nukleo handi eta gingilduna dute; haien zitoplasma handia eta pikortsua da. Monozitoek arrotzak edo kaltegarriak diren substantziak irensten dituzte eta antigenoak immunitate-sisteman parte hartzen duten beste zelulei aurkezten dizkiete. Bi monozito talde daude: zirkulatzen duen taldea eta talde marginala. Monozito gehienak odolean 20-40 ordu egon ostean zirkulazio-sistematik kanpo joaten dira ehun ezberdinetara; eta migrazioarekin batera, monozitoak makrofagoetan[9] edo zelula dendritikoetan desberdintzen dira. Desberdintzapen prozesua jasotzen duten seinaleen araberakoa da.[4] Giza odol litro batean 500 milioi monozito inguru daude.[9]
Makrofagoak
Makrofago helduek gehiegirik migratzen ez duten arren, kanpoko ingurunetik gertu dauden guneetan mantentzen dira, gerta litekeenari aurre egin ahal izateko. Jasotzen dituzten seinaleen arabera, hiru modu ezberdinetara jokatzen dute ehunetan: garbitzaile moduan, antigeno-aurkezle moduan, edo zelula-hiltzaile moduan.[6] Makrofagoak monozitoetatik, granulozito zelula ametatik eta makrofagoetatik (mitosiaren ondorioz) eratorriak izan daitezke. Fagozito mota honek ez du granulorik, baina lisosomak bai ikus daitezke haien zitosolean.[10]
Makrofagoak gehienetan ehunetan daude; oso gutxitan agertzen dira odolean; gorputzean ehun eta organo ia gehienetan daude, eta kokapenak haien tamaina eta itxura baldintzatzen ditu. Makrofagoek hantura eragiten duten zelulak dira, prozesu hori interleukina-1, interleukina-6 eta TNF-alfa ekoizpenaren bidez bideratzen dute.[4]
Makrofagoak aktiba daitezke eta, horrela, monozitoek bete ezin ditzaketen funtzioak aurrera eraman. T zelula laguntzaileak eta linfozitoen azpipopulazio bat dira makrofagoen aktibazioaren arduradunak. Th1 zelulek makrofagoen aktibazioa IFN-gamma seinalearen bidez eta CD40L adieraziz gauzatzen dute. Beste seinale batzuk TNF-alfa eta bakterioetan aurkitzen diren lipopolisakaridoak dira. Th1 zelulek fagozitoak infekzio-gunera erakartzen dituzte; horretarako, hezur-muinean eragiten duten zitokinak askatzen dituzte; zitokina horiek monozitoen eta neutrofiloen sintesia aregotzen dute. Horrekin batera, monozito eta neutrofiloen odolerako migrazioa eragiten duten zitokinak jariatzen dituzte. Th1 zelulak CD4+ T zeluletan dute jatorria, ehun linfoide sekundarioetan antigenoen aurkezpena egin ostean, CD4+ T zelulak Th1 zelulatan ezberdintzen dira.[4]
Neutrofiloak

Neutrofiloak normalean odolean aurkitzen diren zelulak dira; are gehiago, fagozito ugarienetarikoak dira, zirkulatzen duten globulu zuri guztien % 50-60 neutrofiloak baitira.[11] Giza odol litro batean 5 mila milioi neutrofilo inguru daude.[9] Zelula horiek 10 mikrometroko diametroa dute[4] eta 5 egun inguruko bizitza dute.[6] Behin seinaleak jaso dituztenean, 30 minutu inguru behar izaten dituzte infekzio-gunera heltzeko. Azkarrak dira antigorputz edo konplementu-proteinaz ainguratutako gaiak irensten, baita kaltetutako zelulak fagozitatzen ere. Neutrofiloak ez dira odolera itzultzen, hil, eta zorne bihurtzen dira.[6]
Neutrofilo helduak monozitoak baino txikiagoak dira eta nukleo zatikatua dute. Zatiak konektatuta mantentzen dira kromatina-harizpien bidez. Neutrofiloak normalean ez dira hezur-muinean kokatzen heldutasunera heldu arte, baina infekzioa gertatzen denean, neutrofiloen aitzindariak diren metamielozitoak, mielozitoak eta promielozitoak askatzen dira.[12] Giza neutrofiloetan dauden pikorren osagaiak aspaldi identifikatu dira; batez ere, proteinak degradatu eta bakterioak hiltzeko dituzten proprietateengatik dira ezagunak.[13] Neutrofiloen jariakinek monozito eta makrofagoen gaineko eragina izan dezakete; izan ere, fagozitosia areagotu eta zelula barneko hilketa prozesuan agertzen diren oxigeno-espezie erreaktiboen sintesia sustatzen dute.[14] Zehazki, neutrofiloetan aurkitzen diren pikor primarioen jariapenak IgG-z inguratutako bakterioen fagozitosia areagotzen du.[15]
Zelula dendritikoak
Zelula dendritikoak antigeno-aurkezle profesionalak dira. Horietan agertzen diren dendrita izeneko luzakin luzeek[16] gai arrotzen fagozitosian laguntzen dute.[17] Zelula dendritikoak batez ere, kanpo-ingurunearekiko ukipenan dauden ehunetan ageri dira: larruazala, sudur-barrunbea, birikak, sabela, eta hesteak.[9] Aktibatzen direnean, linfa-gongoiletara migratzen dute, eta bertan T eta B linfozitoekiko kontaktuan jartzen dira. Horrela, immunitate-sistema adaptatiboaren erantzuna hasten da. Zelula dendritiko helduek T zelula laguntzaile eta T zelula zitotoxikoen aktibazioa eragiten dute. T zelula laguntzaileek makrofagoekin eta B zelulekin interakzionatzen dute.[18] Horrela, horien aktibazioa gertatzen da. Horretaz gain, zelula dendritikoek nolabait erantzun immunologikoa nola gertatzen den erabakitzeko ahalmena dute, linfa-gongoiletara migratzen dutenean, T zelulen aktibazioa eragin, eta horiek T zelula laguntzaile edo T zelula zitotoxiko bihurtuko diren erabakitzen baitute.[19]
Mastozitoak
Mastozitoek Toll motako hartzaileak (TLR) dituzte mintzean. Zelula dendritikoek, T zelulek, eta B zelulek hartzaile horiekin interakzionatzen dute, eta horrela, haien aktibazioa bideratzen da.[20] Horrenbestez, erantzun immune adaptatiboaren gaineko eragina dute. Mastozitoek MHC II-ak adierazten dituzte, eta beraz, antigeno-aurkezpenean parte hartu dezakete. Hala ere, antigeno-aurkezpenean duten parte-hartzea ez da ondo ezagutzen.[21] Mastozitoek bakterio gram-negatiboak hil eta haien antigenoak prozesatzen dituzte.[22] Bakterioen mintzean dauden finbrien prozesamenduan espezializatzen dira.[23] Aurrekoaz gain, mastozitoek hantura eragiten duten zitokinak jariatzen dituzte.[24] Hori biziki garrantzitsua da; izan ere, prozesu horren bidez infekzio-gunera fagozito gehiago erakartzen dituzte.[25]
Fagozito ez-profesionalak
Hiltzen diren zelulak eta beste gorputz arrotzen aurka egiten profesionalak ez diren fagozitoak ere badaude.[26] Horiei fagozito ez-profesional deritze, eta epitelio-, endotelio-, mesenkima-zelulak eta fibroblastoak bereiz daitezke horien artean. Haien funtzio nagusia ez da fagozitosia, hori dela eta, ez-profezional esaten zaie.[27] Horien adibide dugu fibroblastoa. Fibroblastoak kolagenoaren fagozitosia eragiten du orbainen bermoldatze-prozesuan, eta horrekin batera, partikula arrotzak ere irensteko saiakera egiten du.[28]
Fagozito ez-profesionalak profesionalak baino mugatuago daude fagozitatu dezaketen materiari dagokionez. Izan ere, ez dute hartzaile fagozitiko eraginkorrik.[2] Gainera, horietako askok ez dute oxigeno-espezie erreaktiborik sortzen fagozitosi prozesuaren ondorioz, fagozitatutako materia suntsitzeko lagungarria dena.[29]
| Kokapen-gune nagusia | Fenotipo-aniztasuna |
|---|---|
| Odola, linfa eta linfa-gongoilak | Linfozitoak |
| Odola, linfa eta linfa-gongoilak | NK eta LGL zelulak (large granular lymphocytes) |
| Odola | Eosinofilo eta Basofiloak |
| Larruazala | Epitelio-zelulak |
| Odol-hodiak | Endotelio-zelulak |
| Ehun konektiboa | Fibroblastoak |
Fagozitosia

Fagozitosia partikula solidoen barneraketarako endozitosi-prozesua da. Bizidun zelulabakarretan elikatze-prozesu garrantzitsua da, eta bizidun zelulanitzetan prozesu hori duten zelula espezializatuei fagozito esaten zaie. Fagozitosian 0’5 μm baino handiagoak diren partikulak ezagutu eta barneratzen ditu zelulak, luzakinen bitartez. Barneratutako materiala fagosoma izeneko besikuletan gordetzen da. Fagozitoak gai dira mikrobio patogenoak zein zelula apoptotikoak fagozitatzeko. Hori dela eta, zelula hauek immunitate-babeserako zein homeostasiaren mantenurako balio dute.[30]
Ugaztunetan fagozitosia bereziki bi motatako zelulek egiten dute: makrofagoek eta neutrofiloek. Immunitate-sistemaren zelula fagozitiko espezializatuak dira eta zelula zaharrak, bakterioak eta partikula handiak fagozitatzen dituzte, besteak beste. Bost urrats jarraitzen dituzte: kimiotaxia, adherentzia, irenstea, digestioa eta iraizketa.[31]
Espezifikotasuna partikulen ezagupenerako hartzaileen bidez gauzatzen da. Ezagupena gertatzen denean, seinaleztapen-turrusta aktibatzen da, fagozitosia ekarriko duena. Hartzaile horiek bi taldetan sailkatzen dira: opsoninak eta ez-opsoninak. Hartzaile ez-opsoninak zuzenean dira gai ituaren talde molekularra ezagutzeko. Talde horren barruan daude lektinaren antzeko ezagupenerako molekulak, mikrobioen estekatzaile polianionikoen eta apoptotikoen ezagupenerako hartzaileak eta TLRak. Bestalde, hartzaile opsonikoek kanpoko itu-molekulei lotu diren opsoninak ezagutzen dituzte, esaterako, antigorputzak, konplementuaren proteinak eta fibronektina. Hartzaile garrantzitsuenetarikoak eta ikertuenak Fc hartzaileak (FcR) eta konplementuaren hartzaileak (CR) dira. Fc hartzaileak IgG edo IgA immunoglobulinen zati konstantea ezagutzeko gai dira. Azaldu bezala, CRek ituari lotutako konplementuak ezagutzen dituzte, adibidez, CR3 hartzailea barneratu beharreko partikulari lotutako iC3b konplementuak ezagutzen ditu.[30]
Ekintza-mekanismoak
Mikrobioen suntsitzea fagozitoek aurrera eramaten duten funtzioa da;[32] prozesu hori fagozitoen barnealdean edo kanpoaldean gerta daiteke. Fagozitoek fagozitosi-prozesua egiteko lehen ataza kimiotaxia da. Hantura gorputzak eragiten duen erantzun fisiologikoa da, eta hantura-prozesu horretan fagozitoen metaketa gertatzen da. Patogenoek zauria infektatzean hazi eta ugaldu egiten dira. Orduan metabolismoko produktuak ekoitzi eta fagozitoek faktore kimiotaktikotzat hartzen dituzte hartzaileen bidez. Konplementuaren aktibazioa eragiten duten molekulak ere faktore kimiotaktikotzat hartzen dira. Horiek fagozitoen zitoeskeletoko osagaien eraldaketa sustatzen dute zelulen mugimendurako. Faktore kimiotaktikoen kontzentrazio altuek, bestalde, kontrako efektua izaten dute. Migraziorako lamelipodioak sortzen ditu zelulak.
Hurrengo urratsa opsonizazioa da. Opsonizazioa fagozitosia errazten duen prozesua da, zeinetan opsonina izeneko faktoreen elkarrekintza beharrezkoa den. Opsoninak jariakin pleuralean, mukietan eta serumean daude. Konplementuaren osagaiak eta antigorputzak (bereziki IgG) izan daitezke. Antigorputzek opsnina bezala jokatzen dute partikula antigeniko batekin lotzen direnean.
Azken pausoa fagozitosi bidezko endozitosia da. Barneratu beharreko zelulaz kanpoko materiala mintz plasmatikoz inguratu, eta bakuolo fagozitikoa eratzen da. Hori lisosomarekin batzen da eta, era horretan, barneko materiala digeritzen da digestio-entzimekin kontaktuan jartzen denean.
Oxigenoaren menpeko zelula barneko mekanismoa

Fagozitoak gorputz arrotzen bat irensten duenean, haren oxigeno-kontsumoa igo egiten da. Horren ondorioz, oxigeno-espezie erreaktiboak sortzen dira, propietate antimikrobianoak dituztenak.[33] Espezie horiek patogenoa ez ezik, zelula ere kaltetzen dute. Hortaz, prozesu hori zelula barruko ataletan gertatzen da. Mekanismoa bi azpiataletan banatzen da:[34]
- Lehenengo atala oxigenoaren menpeko ekoizpena da, superoxidoarena, hain zuzen ere.[1] Superoxidoa bakterizida da,[35] eta hidrogeno peroxidoarekin batera dagoenean erreakzionatu eta erreakzioaren produktua oxigeno singletea da; erreakzioaren katalizatzailea superoxido dismutasa entzima da. Gainera, superoxido erradikalek hidroxilo erradikalekin erreakzionatzen dute eta, horiek ere mikrobio arrotzaren kontra egiten dute.[1]
- Bigarren atalean, mieloperoxidasa entzimak hartzen du parte; entzima neutrofiloen pikorretan metatzen da.[36] Hortaz, pikorrak fagosomarekin batzen direnean fagolisosoma sortzeko, mieloperoxidasa entzima fagolisosomara askatzen da. Horrek hidrogeno peroxidoa eta kloroa erabiltzen ditu hipokloritoa sortzeko. Erreakzioaren produktua, hipokloritoa , bakterientzako toxikoa da; horrenbestez, bakteriak suntsitzen ditu.[1]
Oxigenoaren menpekoa ez den zelula barneko mekanismoa
Oxigenoaren menpekoak ez diren 4 metodo erabil ditzakete fagozitoek mikrobioak suntsitzeko. Dena den, horiek ez dira oxigenoaren menpekoak bezain eraginkorrak.
- Kargadun proteinak erabiliz, mikroorganismoaren mintza kaltetzen dute.
- Bakterioaren pareta lisozima entzimaren bidez suntsitzen dute.
- Neutrofiloen granuloetan dauden laktoferrinak baliatzen dituzte eta, horrela, medioan aurkitzen den burdina kendu eta bakterioak hiltzen dira. Izan ere, burdina guztiz beharrezkoa da bakterioen biziraupenerako.[9]
- Proteasen eta entzima hidrolitikoen bidez suntsitutako bakterioen proteinak liseritzen dituzte.[1]
Zelulaz kanpoko mekanismoa
Gamma interferonak oxido nitrikoaren ekoizpena eragiten du; konposatu horren ekoizpena makrofagoek egiten dute. Gamma interferona jariatzen duten zelulak hurrengokoak dira: T CD4+ linfozitoak, T CD8+ linfozitoak, NK zelulak, B linfozitoak, TNK linfozitoak, monozitoak, makrofagoak edo zelula dendritikoak.[37] Makrofagoek oxido nitrikoa jariatzen dute eta haien inguruan aurkitzen diren mikrobioak hiltzen dituzte. Makrofago aktiboek tumoreen nekrosi-faktoreak (TNF) askatzen dituzte. Faktore horiek[1] minbizi-zelulak eta birusek infektatutako zelulak suntsitzen dituzte; eta, immunitate-sistema osatzen duten beste zelulak aktibatzen dituzte.[6]
Birusen aurkako mekanismoa
Birusak zelulen barnean ugaltzen dira. Horretarako, zelulak infektatu behar dituzte; immunitatean parte hartzen duten hartzaileen bidez hori lortzen dute. Birusek zelula infektatzea lortzen dutenean, zelula beraren makineriaz baliatzen dira ugalketa prozesua aurrera eramateko eta, horrela, birusaren ehunka kopia ekoizten dira. Nahiz eta fagozitoak berezko immunitate-sistemako beste osagaiekin batera gai izan birusak muga batean kontrolatzeko, birusak zelula bat infektatu duenean, garrantzi handiagoa du immunitate-sistema espezifikoak, linfozitoek zehazki.[6] Birus-infekzioa dagoen guneetan, linfozitoak immunitate-sistemako beste osagaiak baino ugariagoagoak dira; horrela, meningitis birikoa gertatzen da.[38] Fagozitoak gai dira birusak infektatutako zelulak suntsitzeko. [6]
Jatorri ebolutiboa
Fagozitosia oso ohikoa da zelula mota askotan. Ondorioz, ziurrenik oso goiz agertu zen eboluzioan[39], eukarioto zelulabakarretik garatua. Adibidez, Dictyostelium discoideum amebak bakterioak barneratzen ditu elikatzeko. Ameba-espezie hau oso organismo soziala da, eta agregatuak osatzeko joera du gose denean. Egoera horretan daudenean, bakterio patogenoekiko eta horien toxinekiko erresistentzia baxua da; izan ere, bakterio patogeno bakarra gai da ameba agregatu guztia akabatzeko. Horri aurre egiteko, agregatuaren parte diren ameba batzuk gai dira fagozitosi bidez bai bakterioak bai toxinak barneratzeko. Ameba horiek, fagozitosi horren ondorioz, hil egiten dira beste amebak babesteko[40]. Antzinako immunitate-sistema horrek gaurkoen antza oso handia mantentzen du; izan ere, gaur egun mekanismo berberak erabiltzen dira organismoen babeserako. Animalien erreinu osoan zehar agertzen dira fagozitoak, belaki itsastarretik intsektuetaraino[41].
Erreferentziak
- Abbas, Abul K.; Lichtman, Andrew H.; Pillai, Shiv. (2010). «Preface» Cellular and Molecular Immunology (Elsevier): v. ISBN 978-1-4160-3123-9. (Noiz kontsultatua: 2020-11-09).
- Ernst, Joel D., ed. (2006). Phagocytosis of Bacteria and Bacterial Pathogenicity. doi:. (Noiz kontsultatua: 2020-11-09).
- (Ingelesez) Charles A Janeway, Jr; Travers, Paul; Walport, Mark; Shlomchik, Mark J.. (2001). «Evolution of the innate immune system» Immunobiology: The Immune System in Health and Disease. 5th edition (Noiz kontsultatua: 2020-11-09).
- Roitt's essential immunology. (11th ed. argitaraldia) Blackwell Pub 2006 ISBN 978-1-4051-3603-7. PMC 63703134. (Noiz kontsultatua: 2020-11-09).
- (Ingelesez) Kay, A. B.. (2015-03). «The early history of the eosinophil» Clinical & Experimental Allergy 45 (3): 575–582. doi:. (Noiz kontsultatua: 2020-11-09).
- (Ingelesez) Sompayrac, Lauren M.. (2019-04-15). How the Immune System Works. John Wiley & Sons ISBN 978-1-119-54212-4. (Noiz kontsultatua: 2020-11-12).
- (Ingelesez) Charles A Janeway, Jr; Travers, Paul; Walport, Mark; Shlomchik, Mark J.. (2001). «Induced innate responses to infection» Immunobiology: The Immune System in Health and Disease. 5th edition (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Zen, Ke; Parkos, Charles A. (2003-10). «Leukocyte–epithelial interactions» Current Opinion in Cell Biology 15 (5): 557–564. doi:. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Essential Haematology (4th ed.). Blackwell Science ISBN 978-0-632-05153-3..
- Takahashi, K.; Naito, M.; Takeya, M.. (1996-07). «Development and heterogeneity of macrophages and their related cells through their differentiation pathways» Pathology International 46 (7): 473–485. doi:. ISSN 1320-5463. PMID 8870002. (Noiz kontsultatua: 2020-11-13).
- «1.3.3 Neutrophils, central cells in acute inflammation» web.archive.org 2010-12-31 (Noiz kontsultatua: 2020-11-13).
- Linderkamp, Otwin; Ruef, Peter; Brenner, Birgit; Gulbins, Erich; Lang, Florian. (1998-12). «Passive Deformability of Mature, Immature, and Active Neutrophils in Healthy and Septicemic Neonates» Pediatric Research 44 (6): 946–950. doi:. ISSN 0031-3998. (Noiz kontsultatua: 2020-11-13).
- Phagocytes: Biology, Physiology, Pathology, and Pharmacotherapeutics. .. New York: The New York Academy of Sciences. ISBN 978-1-57331-102-1..
- (Ingelesez) Soehnlein, O.; Kenne, E.; Rotzius, P.; Eriksson, E. E.; Lindbom, L.. (2008-01). «Neutrophil secretion products regulate anti-bacterial activity in monocytes and macrophages: PMN regulate anti-bacterial activity in macrophages» Clinical & Experimental Immunology 151 (1): 139–145. doi:. PMID 17991288. PMC PMC2276935. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Soehnlein, Oliver; Kai-Larsen, Ylva; Frithiof, Robert; Sorensen, Ole E.; Kenne, Ellinor; Scharffetter-Kochanek, Karin; Eriksson, Einar E.; Herwald, Heiko et al.. (2008-10-01). «Neutrophil primary granule proteins HBP and HNP1–3 boost bacterial phagocytosis by human and murine macrophages» Journal of Clinical Investigation 118 (10): 3491–3502. doi:. ISSN 0021-9738. PMID 18787642. PMC PMC2532980. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Steinman, Ralph M.; Cohn, Zanvil A.. (1973-05-01). «IDENTIFICATION OF A NOVEL CELL TYPE IN PERIPHERAL LYMPHOID ORGANS OF MICE» Journal of Experimental Medicine 137 (5): 1142–1162. doi:. ISSN 1540-9538. PMID 4573839. PMC PMC2139237. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Guermonprez, Pierre; Valladeau, Jenny; Zitvogel, Laurence; Théry, Clotilde; Amigorena, Sebastian. (2002-04). «A NTIGEN P RESENTATION AND T C ELL S TIMULATION BY D ENDRITIC C ELLS» Annual Review of Immunology 20 (1): 621–667. doi:. ISSN 0732-0582. (Noiz kontsultatua: 2020-11-13).
- Sallusto, Federica; Lanzavecchia, Antonio. (2002-05-09). «The instructive role of dendritic cells on T-cell responses» Arthritis Research & Therapy 4 (3): S127. doi:. ISSN 1478-6362. PMID 12110131. PMC PMC3240143. (Noiz kontsultatua: 2020-11-13).
- Steinman, Ralph M.. «Introduction to Some of the Issues and Mysteries Considered in this Book on Dendritic Cells» Handbook of Dendritic Cells (Wiley-VCH Verlag GmbH): 3–11. ISBN 978-3-527-61969-6. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Novak, Natalija; Bieber, Thomas; Peng, Wen-Ming. (2010). «The Immunoglobulin E-Toll-Like Receptor Network» International Archives of Allergy and Immunology 151 (1): 1–7. doi:. ISSN 1423-0097. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Kalesnikoff, Janet; Galli, Stephen J. (2008-11). «New developments in mast cell biology» Nature Immunology 9 (11): 1215–1223. doi:. ISSN 1529-2908. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Malaviya, Ravi; Abraham, Soman N.. (2001-02). «Mast cell modulation of immune responses to bacteria: Mast cell modulation of immune responses» Immunological Reviews 179 (1): 16–24. doi:. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Connell, I.; Agace, W.; Klemm, P.; Schembri, M.; Marild, S.; Svanborg, C.. (1996-09-03). «Type 1 fimbrial expression enhances Escherichia coli virulence for the urinary tract.» Proceedings of the National Academy of Sciences 93 (18): 9827–9832. doi:. ISSN 0027-8424. PMID 8790416. PMC PMC38514. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Taylor, Marcia L.; Metcalfe, Dean D.. (2001-05-01). «Mast Cells in Allergy and Host Defense» Allergy and Asthma Proceedings 22 (3): 115–119. doi:. ISSN 1088-5412. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Urb, Mirjam; Sheppard, Donald C.. (2012-04-26). Heitman, Joseph ed. «The Role of Mast Cells in the Defence against Pathogens» PLoS Pathogens 8 (4): e1002619. doi:. ISSN 1553-7374. PMID 22577358. PMC PMC3343118. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Birge, R B; Ucker, D S. (2008-07). «Innate apoptotic immunity: the calming touch of death» Cell Death & Differentiation 15 (7): 1096–1102. doi:. ISSN 1350-9047. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Couzinet, Sabine; Cejas, Elisabeth; Schittny, Johannes; Deplazes, Peter; Weber, Rainer; Zimmerli, Stefan. (2000-12-01). Kaufmann, S. H. E. ed. «Phagocytic Uptake of Encephalitozoon cuniculi by Nonprofessional Phagocytes» Infection and Immunity 68 (12): 6939–6945. doi:. ISSN 1098-5522. PMID 11083817. PMC PMC97802. (Noiz kontsultatua: 2020-11-13).
- Segal, G.; Lee, W.; Arora, P. D.; McKee, M.; Downey, G.; McCulloch, C. A.. (2001-01). «Involvement of actin filaments and integrins in the binding step in collagen phagocytosis by human fibroblasts» Journal of Cell Science 114 (Pt 1): 119–129. ISSN 0021-9533. PMID 11112696. (Noiz kontsultatua: 2020-11-13).
- (Ingelesez) Rabinovitch, Michel. (1995-03). «Professional and non-professional phagocytes: an introduction» Trends in Cell Biology 5 (3): 85–87. doi:. (Noiz kontsultatua: 2020-11-13).
- Rosales, Carlos; Uribe-Querol, Eileen. (2017). «Phagocytosis: A Fundamental Process in Immunity» BioMed Research International 2017 doi:. ISSN 2314-6133. PMID 28691037. PMC 5485277. (Noiz kontsultatua: 2020-11-09).
- Fagozitosi. 2020-09-06 (Noiz kontsultatua: 2020-11-09).
- Dale, David C.; Boxer, Laurence; Liles, W. Conrad. (2008-08-15). «The phagocytes: neutrophils and monocytes» Blood 112 (4): 935–945. doi:. ISSN 1528-0020. PMID 18684880. (Noiz kontsultatua: 2020-11-12).
- (Ingelesez) Dahlgren, Claes; Karlsson, Anna. (1999-12). «Respiratory burst in human neutrophils» Journal of Immunological Methods 232 (1-2): 3–14. doi:. (Noiz kontsultatua: 2020-11-12).
- Fang, Ferric C.. (2004-10). «Antimicrobial reactive oxygen and nitrogen species: concepts and controversies» Nature Reviews. Microbiology 2 (10): 820–832. doi:. ISSN 1740-1526. PMID 15378046. (Noiz kontsultatua: 2020-11-12).
- Shatwell, K. P.; Segal, A. W.. (1996-11). «NADPH oxidase» The International Journal of Biochemistry & Cell Biology 28 (11): 1191–1195. doi:. ISSN 1357-2725. PMID 9022278. (Noiz kontsultatua: 2020-11-12).
- (Ingelesez) Klebanoff, Seymour J.. (1999-09). «Myeloperoxidase» Proceedings of the Association of American Physicians 111 (5): 383–389. doi:. (Noiz kontsultatua: 2020-11-12).
- (Ingelesez) Schroder, Kate; Hertzog, Paul J.; Ravasi, Timothy; Hume, David A.. (2004-02). «Interferon-γ: an overview of signals, mechanisms and functions» Journal of Leukocyte Biology 75 (2): 163–189. doi:. (Noiz kontsultatua: 2020-11-12).
- de Almeida, Sérgio Monteiro; Nogueira, Meri Bordignon; Raboni, Sonia Mara; Vidal, Luine Rosele. (2007-10). «Laboratorial diagnosis of lymphocytic meningitis» The Brazilian Journal of Infectious Diseases: An Official Publication of the Brazilian Society of Infectious Diseases 11 (5): 489–495. doi:. ISSN 1413-8670. PMID 17962876. (Noiz kontsultatua: 2020-11-12).
- Bozzaro, Salvatore; Bucci, Cecilia; Steinert, Michael. (2008). «Phagocytosis and host-pathogen interactions in Dictyostelium with a look at macrophages» International Review of Cell and Molecular Biology 271: 253–300. doi:. ISSN 1937-6448. PMID 19081545. (Noiz kontsultatua: 2020-11-26).
- Chen, Guokai; Zhuchenko, Olga; Kuspa, Adam. (2007-08-03). «Immune-like phagocyte activity in the social amoeba» Science (New York, N.Y.) 317 (5838): 678–681. doi:. ISSN 1095-9203. PMID 17673666. PMC 3291017. (Noiz kontsultatua: 2020-11-26).
- Fries, Michael; Kunitz, Oliver. (2006-08). «Response to Mannam et al.» European Journal of Emergency Medicine 13 (4): 250. doi:. ISSN 0969-9546. (Noiz kontsultatua: 2020-11-26).