Erregai-pila
Erregai-pila, erregai-zelula edo erregai-gelaxka, energia kimikoa energia elektrikoan eraldatzen duen gailua da; gailu elektrokimikoa, alegia. Pilaren barruan, erregaiz eta oxidatzailez osaturiko fluxu jarraituak kontrolpeko erreakzio kimikoa pairatzen du; fenomeno horren ondorioz sortutako produktuek kanpo-zirkuitua korronte elektrikoz hornitzen dute.

Bateriaren tankerako energia-bihurgailu elektrokimikoa da erregai-pila. Ezberdintasun nagusia, kontsumitutako erreaktiboen hornikuntza jarraian aurkitzen da. Hau da, elektrizitatea sortzeko erregaiz eta oxigenoz[1] (edo beste oxidatzaile batez) osatutako kanpo iturriaz baliatzen da; haatik, bateriak energia metatzeko ahalmen mugatua du. Gainera, bateria kargatua edo deskargatua dagoen heinean, elektrodoek modu ezberdinean erreakzionatzen dute; erregai-pilan, ordea, katalitikoak eta erlatiboki egonkorrak dira elektrodoak.
Gertatzen den prozesu elektrokimikoak efizientzia altua eta ingurumen-inpaktu urria du. Izan ere, erregai-pilen energia lorpenak ez du inolako prozesu termiko edo mekanikorik behar. Normalean, erregai-pilaren efizientzia energetikoa % 40-60 artean dago eta kogenerazioan % 85-90 tarteko balioak har ditzake. Bestalde, prozesuak ez duenez erreaktibo konbustiorik inplikatzen, emisio kutsakorrak oso baxuak dira.[2]
Garrantzitsua da pila konbentzionalen eta erregai-pilen arteko oinarrizko ezberdintasunak ezartzea. Pila konbentzionalak energia metatzeko gailuak dira: erregaia estrukturaren barnean dago eta kontsumitu arte energia ekoizten dute. Aldiz, erregai-pilan erreaktiboak kanpotik datorren fluxu jarraitutik hornitzen dira eta horri esker energia etengabe sortzen da.
Printzipioz, erregai-pilek askotariko erreduktoreak eta oxidatzaileak prozesa ditzakete. Erreduktorea, erreakzio kimiko batean oxida daitekeen edozein sustantzia izan daiteke; gainera, era jarraituan horni daiteke pilaren anodora. Era berean, oxidatzailea izan daiteke katodoan gertatzen den erreakzioan erreduzitu daitekeen edozein fluxu.[3]
Erregai-zelulen lehenengo aplikazioetako bat ibilgailu espazialetan eman zen, hidrogeno eta oxigenoaren erreakzioan oinarrituz, emaitza moduan ura emanez, astronautek edan dezaten edo ibilgailuko hozketa sistema gisa erabil dadin.
Erregai-pilen merkatua hazten ari da. Pike Researchek 2003an aurresan zuen 2020an erregai-pila egonkorren merkatua 50 GW-eko potentziara heldu dela.[4]
Historia
Erregai-pilen historia XIX. mendean hasi zen, eta 1838an lehenengo ikerketak egin ziren. Alde batetik, Christian Friedrich Schönbein zientzialariak Suitzan egindako probekin eta bestaldetik, Sir William Grove fisikariak gas bateriekin egindako ikerketekin.
Gaur egun, aplikazio anitz dituzte zelula horiek, batez ere garraioaren esparruan. Halere, pilaren garapenak hainbat periodo zail pairatu ditu denboran zehar, elektrizitatea lortzeko beste metodo batzuek baino zailtasun gehiago dituztelako. Erregai-zelularen gaineko interesa, eta ondorioz bere garapena, baliabide energetikoen urritasunarekin batera etorri da beti. Adibidez, 1973ko petrolio-krisian energia ekoizteko ordezko teknologiak garatu ziren eta beraien artean erregai-pila zegoen.
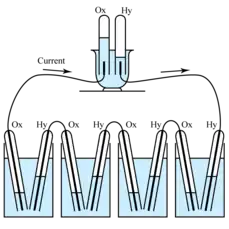
Ondoko irudian, William R. Grovek "On the Gas Voltaic Battery" argitalpenean komunitate zientzialariari aurkeztutako gailua agertzen da.[5] Bere egituran, platinozko elektrodo bi murgildu zituen azido sulfurikoan, oxigenoz eta hidrogenoz elikatzen zituenak, hurrenez hurren. Grovek horrelako 50 zelda konektatu zituen, uraren elektrolisia gauzatzeko behar adina potentzial sortuz.
Ondoren, Lord Rayleighek konfigurazio originala hobetu zuen. Groveren lanek Rayleighen interesa piztu zuten eta 1882an bertsio efizienteagoa aurkeztu zuen; horretarako platinoaren, gas erreaktiboen eta elektrolitoaren arteko ukipen gainazala handiagotu zuen.
Ludwig Mondek eta Charles Langerrek "erregai-pila" terminoa erabili zuten lehenengo aldiz mota honetako gailuak aipatzeko garaian. 1889. urtean, bi zientzialari horiek sekulako aurrerapena egin zuten, elektrolito likidoan murgildutako elektrodoen inguruko problemari irtenbidea aurkituz. Beraien prototipoa platinozko edo urrezko geruza finaz estalita zegoen; era horretan, elektrolitoa matrize solido isolatzaile batean manten zezakeen.[6]
XX. mendearen erdialdean, gailu horiek egundoko aurrerapausoa eman zuten garapen teknologikoari dagokionez. 1954an, Francis Thomas Bacon zientzialari ingelesak 5 KW-eko planta energetikoa eraiki zuen erregai-pila alkalino batekin. Pilaren estruktura honakoa zen: nikelezko anodoa, nikel eta litio oxidozko katodoa, eta %85 potasio kontzentrazioa zuen hidroxidozko elektrolitoa. Pila hidrogenoz eta oxigenoz elikatzen zen.[7] 60ko hamarkadan, Baconen patenteak AEBen programa espazialean erabili ziren astronautak edateko urez eta elektrizitatez hornitzeko, espazio-ontziko tankeetako hidrogenoaz eta oxigenoaz baliatuz.
1959an, Harry Ihrigen gidaritzapean zegoen taldeak 15 KW-eko erregai-piladun traktorea eraiki zuen Allis-Chalmersentzako, AEBetako estatu ferietan erakusgai egon zena. Sistema honek potasio hidroxidoa erabili zuen elektrolito gisa, eta bestaldetik, hidrogeno eta oxigeno konprimituak erreaktibo moduan.
General Electricek protoien trukaketarako mintza duen lehenengo pila (PEMFC) garatu zuen NASAko Gemini misio espazialetarako. PEFC teknologia Gemini V. misioan erabili zen lehendabiziko aldiz. Haatik, Apolo Programako misioetan eta bere ondorengoetan, Baconen diseinuan oinarrituriko erregai-gelaxkak erabili ziren, Pratt & Whitney Aircraftek garatuak.[8] 1960. urtetik aurrera, erregai-pilak hegaldi espazial eskifaietan erabili ziren. Gaur egun, oraindik ere aplikazio aeroespazialetan erabiltzen dira.
1970 eta 1980 artean, petrolio-krisia eta energia lortzeko ordezko teknologien bilaketaren ondorioz, erregai-pilen kostua murrizteko, beharrezko materialak zeintzuk diren identifikatzeko eta erregaien iturri optimoak ikertu zituzten.
1980ko hamarkadan, erregai-zelulen erabilera probatu zen zerbitzu publikoetan; horrez gain, ibilgailuen fabrikazioan txertatzen saiatu ziren. 1990eko hamarkadan, lokal komertzial eta industrialentzako erregai-zelula egonkorrak garatu ziren.
1993. urtean, Ballar enpresa kanadarrak erregai-pilaz baliaturiko lehen ibilgailu komertziala garatu zuen, PEM teknologia erabiliz.[9]
2007an, erregai-pilak komertzializatzen hasi ziren aplikazio egonkorrentzat eta aldi berean osagarrientzat. 2008. urtean, Honda enpresak erregai-pilan oinarrituriko ibilgailuen salmentari hasiera eman zion. Urte berean, Gerhard Ertlek Kimikako Nobel Saria irabazi zuen, bere ikerketen ondorioz erregai pilen funtzionamendua ulertu baitzuten. Panasonic izan zen etxeko erabilerako lehen erregai-pila salmentan jarri zuena. Bere merkaturatzetik (2009ko maiatza) 2013ko irailera arte, 31.000 unitate saldu zituen Japonian.
2013. urtean, pila eskuragarrietarako trantsizioa adieraz dezakeen erregai-pila aurkeztu zen. "ACAL Energy" enpresa britainiarrak 10.000 orduko erresistentzia proba gainditu zuen erregai-pila garatu zuen.[10] ACAL enpresaren FlowCath® teknologia eta ohiko hidrogeno pilaren arteko ezberdintasun nagusia bere katalizatzailean aurkitzen da, hau da, lehenengoa ez da platinozko katalizatzailean oinarritzen, eta ondorioz, pilaren kostua potentzialki murrizten da. Platinozko katalizatzailea, katalizatzaile likido patentatu batengatik ordezkatu da, honek hozgarri moduan lan egiten du eta era berean, pilaren bizitza erabilgarria luzatzen du.
Teknologia
Erregai-pilaren funtzionamendua ohiko bateriaren antzekoa da. Elektrizitatea lortzeko, sustantzia kimiko ezberdinen erreakzioa gertatzea ezinbestekoa da. Alabaina, baterien ahalmenak limite bat du. Erregai-pilak, aldiz, erreaktiboen hornidura jarraitua ahalbidetzen du.

Erregai-pila mota ezberdinak daudenez, PEM (ingeleseko Proton Exchange Membrane) motakoa erabiltzen da beraien oinarrizko funtzionamendua azaltzeko. Pila mota honen oinarrizko eskema eskuineko irudian ikus daiteke. Bere osaerari erreparatuz, bi elektrodoz eratuta dago: anodoa (non erregaia oxidatzen den) eta katodoa (non oxidatzailea erreduzitzen den). Elektrolitoak, berriz, hiru funtzio betetzen ditu: isolatzaile elektrikoarena, eroale protonikoarena eta erreakzioen banatzailearena. Azken funtzio hori dela eta, elektroiak anodotik katodora bidaiatzeko, kanpo zirkuitu batez baliatzen dira. Era horretan, korronte elektriko bat sortzen dute. Protoiak, aldiz, anodotik katodora joateko elektrolitoa zeharkatzen dute. Katodoan, elektroiak, protoiak eta erregaia erreduzitzen dira, emaitza gisa produktuak sortuz. Erreakzio hori exotermikoa da, eta espontaneoa den arren, katalizatzaile gabe gertatzeko mantsoegia izaten da. Izan ere, normalean elektrodoak katalizatzaile moduan erabiltzen dira. Pila mota honetan, hidrogenoa erreduktorea izaten da eta oxigenoa oxidatzailea.
Aipatu beharra dago, erdiko mintza era egokian hezetua egon behar dela, protoiek mintza zeharka dezaten. Hortaz, ohikoa da mintza pilan barneratu aurretik gasak hezetzea.
Erregai-pilak erabiltzen duten elektrolitoaren eta erregaiaren funtzioan sailka daitezke. Gertatuko den erreakzio mota bi ezaugarri horiek determinatuko dute. Gaur egun, garapen prozesuan dauden erregai-zelula gehienek hidrogenoa erabiltzen dute. Elementu horrek, erreaktibotasun altua du eta prozesu ezberdinetatik lor daiteke. Bestalde, oxidatzailerik arruntena gas-oxigenoa da, erabilgarritasun altua baitu. Hidrogenoa eta oxigenoaren arteko konbinazioaren emaitzak produktu bakarra ematen du: ura. Hori dela eta, aplikazio espazialetan erabiltzen da elkarketa hori. Gainera, oxigenoa eta hidrogenoa modu trinkoan bil daitezke.
Gelaxka bakarraz sortutako potentzial-diferentzia ez da volt batera iristen; horregatik, gelaxkak seriean konektatu behar dira aplikazio arruntetan erabili ahal izateko. Beraz, erregai-pilen sistemak erabiltzen dira praktikan.
Tentsioa
Gelaxka bakoitzeko tentsioa kargako korrontearen menpe dago. Zirkuitu irekian 1,2 voltekoa da. Potentzial-diferentzia nahikoa sortzeko, serie eta paralelo egiturak konbinatuz eratzen dira gelaxkak (ingeleseko Fuel Cell Stack). Oro har, 45 unitate baino gehiago erabiltzen dira diseinuaren arabera.
Materialak
Gelaxketan erabilitako materialak gelaxka motaren araberakoak dira. Elektrodo plakak normalean metalezko, nikelezko edota ikatzezko tutu ñimiñoz osatuta daude. Era berean, plaka horiek platinozko edo paladiozko katalizatzaile batez estaliak daude. Elektrolitoa zeramikazkoa izan daiteke edo mintz polimeriko batez osatutakoa.
Erregai-pilen diseinuan aintzat hartu beharrekoak
- Kostuak. 2002. urtean, gelaxka arrunten prezioa 850 €/kW energia elektriko erabilgarrikoa zen. Prezio hori murrizteko, katalizatzailearen materialen inguruan ikertzea ezinbestekoa da.
- Uraren kudeaketa PEMFCetan. Erregai-pila mota honetan, ura lurruntzen den heinean mintza hidratatu behar da. Izan ere, mintzaren hidratazioa ez bada modu egokian burutzen, zirkuitulaburrak sor litezke.
- Tenperaturaren kudeaketa. Tenperatura uniformea izan behar da gelaxka osoan zehar.
- Fluxuaren kontrola. Funtzionamendua zuzena izan dadin, erreaktiboaren eta oxigenoaren arteko erlazioa konstantea izan behar da.
- Bizitza erabilgarria. Erabilera egonkorrentzako pilen bizitza erabilgarria 40.000 ordukoa izan behar da. Aldiz, automobilgintzako pilena 5.000 ordu ingurukoa izan behar da, 200.000 kilometro ingurukoa, alegia.
Erregai-pila motak
Gaur egun, erregai-pila mota ugari daude, zeinak garapen etapa ezberdinetan dauden. Hori dela eta, beren ezaugarrien arabera sailka daitezke, eta honako hauek dira arruntenak:[11]
- Erregai eta oxidatzaile konbinazio motaren arabera.
- Erabilitako elektrolito motaren arabera.
- Operazio-tenperaturaren arabera.
- Efizientziaren arabera.
- Erabilera motaren arabera.
- Potentziaren arabera.
- Erabilitako katalizatzailearen arabera.
Aipatutako sailkapenen artean ohikoena bigarrena da, hau da, elektrolito motaren araberakoa. Hortaz, sailkapen horri jarraituz, sei pila mota nagusi bereizten dira.
Truke protonikorako mintza duen erregai-pila (PEM)
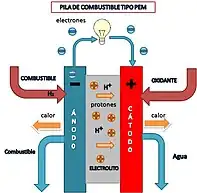
- Elektrolitoa: polimero solidoko mintza
- Katalizatzailea: platinoa
- Operazio tenperatura: 80-95 °C inguru
- Efizientzia elektrikoa: % 40-60
PEM pilek tenperatura baxuetan operatzen dute eta potentzia-dentsitate oso altua dute. Gainera, oso azkar alda dezakete beraien irteerako potentzia eskari energetikora egokitzeko. Izan ere, beraien potentzia watt gutxi batzuetatik kilowattetara aldatzen dituzten PEM pilak garatu dira, sistema ezberdin anitzetan erabil daitezkeenak.
Funtzionamendu erantzun azkarra behar duten aplikazioetan PEM pilez osatutako sistemak erabiltzen dira. Hortaz, telekomunikazio eta ibilgailuen merkatuetan zentratzen dira. Aplikazio mota horietarako, erregai hauek erabili ohi dituzte: hidrogenoa, metanola edo eraldaturiko erregaiak.
PEM piletako elektrolitoa polimero solidoko mintz bat da. Mintz honek, azido sulfoniko perfluoratuak ditu eta protoien eroapen egokia bermatzeko hidratatua mantendu behar da. Etengabeko hidratazio horren ondorioz, operazio tenperatura 100 °C-tik behera mantentzen da eta efizientzia hobetzen. Gainera, erabilitako likido bakarra ura denez, korrosio arazoak minimoak dira.[12]
Gaur egun, pila honen garapenak dituen erronka nagusiak hauek dira: kostua murriztea eta efizientzia handitzea (platinozko geruzaren lodiera murriztuz); mintz polimerikoaren ezaugarriak hobetzea (konduktibitate ionikoa eta uraren erretentzio ahalmena handituz); eta plaka bipolarrerako grafitoaren ordezko material bat aurkitzea (konduktibitatea eta korrosioaren aurkako erresistentzia hobetuz).
Metanolezko erregai-pila (DMFC)

- Elektrolitoa: polimero solidoko mintza
- Katalizatzailea: platinoa
- Operazio tenperatura: 50-120 °C inguru
- Efizientzia elektrikoa: % 40 baino altuagoa
PEM pilen antzera, DMFC pilek polimerozko mintz bat erabiltzen dute elektrolito gisa. Haatik, DMFC sistemetan erregaia ez da eraldatzaile batetik pasarazten; izan ere, anodo katalizatzaileak berak, metanol likidotik ateratzen du hidrogenoa. Pila mota honen operazio-tenperatura baxua dela eta, tamaina txikiko aplikazioetarako erabil daiteke. Adibidez, telefono mugikorretan, ordenagailu eramangarrietan eta gailu elektronikoentzako bateria kargadoreetan.[13] Honez gain, tamaina ertaineko aplikazioetan ere erabil daiteke, hala nola, itsasontzietako elektronika elikatzeko.
DMFCek duten erronkarik handiena mintz berri bat aurkitzean datza. Mintz honek, 130 °C-tik gorako tenperaturetan lan egiteko ahalmena eduki behar du inolako arazorik eman gabe. Bestalde, metanolaren oxidaziorako katalizatzaile hobearen bilaketan ere murgildu dira zientzialariak.[12]
Erregai-pila alkalinoak (AFC)

- Elektrolitoa: uretan disolbaturiko potasio hidroxido soluzioa
- Katalizatzailea: metal ez preziatuak
- Operazio tenperatura: 105-245 °C inguru
- Efizientzia elektrikoa: % 60-70
AFCetan erabiltzen diren erregaiak hidrogeno eta oxigeno puruak izan behar dira. Izan ere, CO2ak (edo COak) eta KOHak erreakzionatzen dutenean, karbonato potasikoa sortzen da eta honek efizientzia izugarri murrizten du. Kontzentrazio txikiak (10-100 ppm) izan arren, pilaren "pozoidura" gertatzen da CO2aren (edo COaren) erruz.[14] Arrazoi horrengatik, sektore aeroespazialean eta urpeko aplikazioetan erabiltzen da normalean.
Pila mota honen errendimendua besteena baino altuagoa da. Hori dela eta, esplorazio espazialetan erabili ohi dira; izan ere, NASAk 1960. urtetik aurrera hidrogenoz elikaturiko AFC pilak erabili ditu bere misioetan, ura eta elektrizitatea lortzeko baliabide bikaina baitira.[15]
Azido fosforikozko erregai-pilak (PAFC)
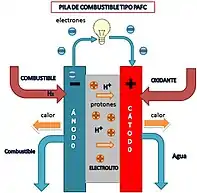
- Elektrolitoa: azido fosforiko likidoa
- Katalizatzailea: platinoa (karbonozko basearen gainean)
- Operazio tenperatura: 180-205 °C inguru
- Efizientzia elektrikoa: % 36-42
PAFC motako pilek hidrokarburoak edo biogasak erabiltzen dituzte erregai gisa. Katodoan eta anodoan emandako erreakzioak PEM pilek pairatzen dituztenen antzekoak dira; halere, PAFCen operazio tenperatura altuagoa da eta erregaien ezpurutasunak hobeto toleratzen dituzte. Gaur egun, PAFCen komertzializazioa kogenerazioaren esparruan oso zabalduta dago.
1991. urtean, UTC korporazioak PAFC teknologian oinarrituriko lehen potentzia-sorkuntza planta merkaturatu zuen. Erabilitako PureCell potentzia sistemak 200 kW eta 850 J hornitzen ditu orduro. Teknologia hori duten sistema guztien operazio orduak metatuz, 6 milioi orduak gainditzen dituzte.
Urtutako karbonatuzko erregai-pilak(MCFC)

- Elektrolitoa: karbonato alkalinoak (zeramikazko matrize baten gainean)
- Katalizatzailea: elektrodoena (platinoa ez)
- Operazio tenperatura: 650 °C inguru
- Efizientzia elektrikoa: % 50-60
Erregai-pila mota honen operazio tenperatura altuak direla eta, pilaren barnean bihurtzen da erregaia hidrogeno. MCFCak normalean ez dutenez kutsadurarik sortzen (CO edo CO2), karbonotik eratorritako gasekin elika daitezke. Beraien aplikazioak kogenerazioarekin erlazionatuak daude batik bat.
MCFC pilen teknologia denbora asko darama garapen prozesuan; teknologia horretan aurreratuen dauden enpresak MTU, eta bere bazkide amerikarra, Fuel Cell Energy izanik.
Oxido solidozko erregai-pilak(SOFC)

- Elektrolitoa: solido zeramikoa edo oxido metaliko ez-porotsua
- Katalizatzailea: elektrodoena (platinoa ez)
- Operazio tenperatura: 800-1000 °C inguru
- Efizientzia elektrikoa: % 50-60
SOFCak tenperatura altuetan operatzeko diseinatuak daude; tenperatura horiek direla eta, hidrokarburo arinak eralda ditzakete pilaren barnean. Hortaz, hidrokarburo astunagoak erabili nahi badira, kanpo-eraldatzaile baten laguntza beharrezkoa izango da. Mota honetako pilen formari dagokionez, lauak edo tutu formakoak ikus daitezke. Gainera, SOFCak aplikazio egonkor ugaritan erabiltzen dira mundu osoan zehar.[16]
SOFC teknologia erabiltzen duten pilek 800-1000 °C inguruko tenperaturetan operatzen dutenez, tenperatura hori 600-800 °Cetara (IT-SOFC, "Intermediate Temperature Solid Oxide Fuel Cell") jaitsi nahi da. Helburu hori betetzeko, elektrolitoaren geruza nola txikiagotu ikertzen ari dira.
Aplikazioak
Energia
Hainbat aplikazioetan energia-iturri gisa erabili dira erregai-pilak, hala nola, espazio-ontzi, erabilera militar edota landa-eremuetan. Hidrogenoarekin funtzionatzen duten erregai-pilez osatutako sistemak konpaktuak eta arinak izan daitezke. Gainera, ez dute pieza mugikor garrantzitsurik edukitzen, eta horren ondorioz, beren fidagarritasuna % 99,9999 baliora irits daiteke.[17]
Hurrengo atalean sakonago azaltzen den kogenerazio aplikazioetan ere erregai-pilak erabiltzen dira. Sistema mota horrek, energia elektrikoa sortzen du era jarraituan (energia-soberakinak sareari salduz), aldi berean, airea eta ura berotzen ditu askatutako beroari esker.
Landa-eremuetan erabiltzen diren sistemei dagokienez, sistema elektrolizatzaileek ez dutenez erregai-biltegirik, biltegiratzeko kanpo-unitateak erabili ohi dituzte.[18] Kasu honetan, tamaina handiko bateriak erabili behar dira biltegiratzearen eskaria asetzeko; dena den, kanpo-unitateen erabilerak aurrezpen bat suposatzen du dispositibo konbentzionalekin erkatuz.
Washingtonen programa esperimental bat existitzen da,[19] non Stuart Island Energy Initiative konpainiak erregai-pila sistema berritzaile bat eraiki duen. Sisteman, plaka fotovoltaikoek sortzen duten korronteari esker, hainbat elektrolizatzaileek hidrogenoa ekoizten dute. Hidrogeno hori 1900 litroko edukiera duen tanke batean biltegiratzen da (10-80 barretako presioan). Azkenik, hidrogenoa erregai gisa erabiltzen da erregai-gelaxka bat funtzionarazteko, eta gelaxka horri esker, irla osoa energia elektrikoz hornitzen da.
Zabortegi edo hondakin-uren tratamendu plantetan agertzen diren gasekin ere erabil daitezke erregai-pilak. Horiek profitatuz, energia sortzen den bitartean, metano emisioak murritz daitezke. Energia sortzera bideratua dagoen eta erregai-pilez baliatzen den munduko plantarik handiena Kalifornian kokatua dago.
Protium, Gloecesterren sortutako rock musika taldea, energiaz hornitzeko erregai-gelaxkak aprobetxatu zituen lehen multzo musikala izan zen. Taldeak, Airgen FuelCell izeneko kilowatt bateko gelaxka erabiltzen zuen beraien kontzertuetarako. Gainera, erregai-pilak sustatzeko hainbat ekitaldietan parte hartu dute; esate baterako, 2003. urtean Miami Beacheko Fuell Cell Seminar ekitaldian.
Kogenerazioa
Energia eta beroa sortzeko erregai-pilen sistemak (CHP), mikrosistemak ere aintzat hartuz (MicroCHP), eraikinak energiaz eta beroaz hornitzeko erabiltzen dira. Sistema horiek, energia elektrikoa ekoizten dute era jarraituan (energia-soberakinak sareari salduz), eta aldi berean, airea eta ura berotzen dituzte askatutako hondakin-beroari esker. Energia primarioa aurrezteko CHP sistemak erabiltzen dira honako eraikin hauetan: etxebizitzak, bulegodun eraikinak, fabrikak, etab.
Udan, erregai-piletako hondakin-beroa zuzenean zorura barreia daiteke, hozte gehigarri bat lortuz. Neguan, ordea, eraikina berotzeko helburuarekin, hondakin-beroa eraikinera barreiatzen da. Sistema mota horren patente-eskubideak Minnesotako Unibertsitateak ditu.[20][21]
Kogenerazio sistemen errendimendua % 85 baliora irits daiteke (% 40-60 elektrikoa eta gainerakoa termikoa). Alde batetik, azido fosforikozko erregai-pilak (PAFC) erabilienak dira CHP motako produktuetan, % 90 inguruko efizientzia konbinatua lortzen da.[22] Bestetik, urtutako karbonatuzko pilak (MCFC) eta oxido solidokoak (SOFC) CHP sistemetan ere erabiltzen dira, baina beraien efizientzia % 60 ingurukoa izaten da. Azken sistema horiek, bi desabantaila nagusi dituzte: kostu altukoak dira eta beraien iraupena urria da.[23]
Automobilak
Gaur egun, erregai-piladun ibilgailuen ekoizpena geldirik dago; hala eta guztiz ere, azkeneko urteetan hainbat prototipo aurkeztu dira. Orain arte, ibilgailuen autonomia areagotzea izan da ikertzaileen eta diseinatzaileen erronkarik garrantzitsuena. Ibilgailu marka handienek aurreikusten dutenez, hurrengo urteetan hidrogenozko erregai-pilan oinarritutako autoak bideragarriak izango dira.
Autobusak
2011. urtean, 100 erregai-piladun autobus erabilgarri zeuden sakabanatuta munduan zehar. Horietako autobus gehienak UTC Power, Toyota, Ballard, Hydrogenics eta Proton Motor enpresek fabrikatutakoak dira. Erregai-pilak erabiltzen dituzten ibilgailu horiek, diesela eta gas naturala erabiltzen duten ohiko autobusak baino errendimendu hobeagoa dute.
Karga-jasogailuak
Erregai-pilen teknologia erabiltzen duten karga-jasogailuak PEM motako erregai-pilez osatuta daude. Teknologia horri esker, industriako lantegietan materialak jaso eta garraiatzeko erabiltzen dira.
2013. urtean, mota horretako 4.000 karga-jasogailu erabiltzen ziren AEBn kokatutako enpresa garrantzitsu ezberdinetan, horien artean: Sysco Foods, Fedex Freight, GENCO eta H-E-B Grocers. 2020erako karga-jasogailu industrialen eskaria haztea espero du Pike Researchek.
Itsasontziak
HYDRA izan zen erregai-piladun lehen itsasontzia. Bere ezaugarrien artean, AFC teknologiaren erabilera eta 6,5 KW-etako potentzia mugitzen zuela nabarmentzen dira.
Hurrengo urteetarako erregai-pilen teknologia bultzatzeko asmoz, bere arrantzarako ontziteria osoa erregai-pilez hornituko du.
Orain dela gutxi, Amsterdameko hiriko kanalak zeharkatzen dituen erregai-piladun ferry bat jarri da martxan.
Erreferentziak
- (Gaztelaniaz) Dietsche, Karl-Heinz. (2005). Manual de la técnica del automóvil. Reverte ISBN 9783934584822. (Noiz kontsultatua: 2017-11-30).
- (Ingelesez) Notter, Dominic A.; Kouravelou, Katerina; Karachalios, Theodoros; Daletou, Maria K.; Haberland, Nara Tudela. (2015-07-03). «Life cycle assessment of PEM FC applications: electric mobility and μ-CHP» Energy & Environmental Science 8 (7): 1969–1985. doi:. ISSN 1754-5706. (Noiz kontsultatua: 2017-11-30).
- Appleby, A. J.,. (1989). Fuel cell handbook. Van Nostrand Reinhold ISBN 0442319266..
- Stationary Fuel Cells Market size to reach 350,000 Shipments by 2022. (Noiz kontsultatua: 2017-11-30).
- (Ingelesez) London and Edinburgh Philosophical Magazine and Journal of Science. London 1838 (Noiz kontsultatua: 2017-11-30).
- Fuel cell technology handbook. CRC Press 2003 ISBN 142004155X..
- Bacon, F.T., Research into the properties of the hydrogen-oxygen fuel cell, BEAMA Journal, 61, 6–12, 1954.
- Morrill, C.C., Apollo fuel cell system, Proceedings of the 19th Annual Power Sources Conference, New Jersey, 18–20 May, 1965, pp. 38–41
- Howard, P. and Greenhill, C., "Ballard PEM Fuel Cell Powered ZEV Bus," SAE Technical Paper 931817, 1993, doi:10.4271/931817.
- .
- (Ingelesez) Fuel Cell HandBook, Seventh Edition, EG&G Technical Services, Inc., 2004.
- (Gaztelaniaz) APPICE: Asociación Española de Pilas de Combustible. (Noiz kontsultatua: 2017-11-30).
- (Gaztelaniaz) «Toshiba muestra pilas de combustible para móviles en acción [CEATEC 2009»] Engadget en español (Noiz kontsultatua: 2017-11-30).
- (Ingelesez) Gottesfeld, S. and Pafford, J., «A new approach to the problem of carbon monoxide poisoning in fuel cells operating at low temperatures», Journal of the Electrochemical Society, 135, 2651–2652, 1988.
- (Gaztelaniaz) Ricardo Escudero-Cid, Enrique Fatás, Juan Carlos Pérez-Flores eta Pilar Ocón, Pilas de combustible: una alternativa limpia de producción de energía, 2013.
- http://www.fuelcell.no/fuel_cell_types_sofc_es.htm.
- https://web.archive.org/web/20070928225430/http://www.fuelcells.org/basics/benefits.html.
- https://web.archive.org/web/20110515080800/http://www.fuelcells.org/basics/apps.html.
- (Ingelesez) Stuart Island Energy Initiative. (Noiz kontsultatua: 2017-12-03).
- https://web.archive.org/web/20120518094954/http://www.fchea.org/core/import/PDFs/CHP%20Fact%20Sheet.pdf.
- https://web.archive.org/web/20210224203754/http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=HITOFF&p=1&u=%2Fnetahtml%2FPTO%2Fsearch-bool.html&r=2&f=G&l=50&co1=AND&d=PTXT&s1=7,334,406&OS=7,334,406&RS=7,334,406.
- Wayback Machine. 2011-12-11 (Noiz kontsultatua: 2017-12-03).
- http://www1.eere.energy.gov/hydrogenandfuelcells/fuelcells/pdfs/fc_comparison_chart.pdf.