Dipolo
Elektromagnetismoan bi dipolo mota bereizten dira (hitza grezieratik dator (δίς (dis)[1], "bi aldiz" y πόλος (polos)[1][2]):
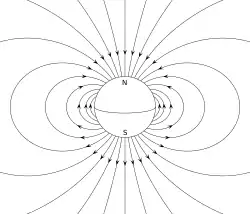
- Dipolo elektriko batek edozein sistema elektromagnetikotan dauden karga positiboak eta negatiboak bereizten ditu. Sistema horren adibide sinple bat magnitude bereko eta kontrako zeinuko karga elektriko pare bat da, distantzia txiki batez bereizia. (Dipolo elektriko iraunkor bati electret deritzo)
- Dipolo magnetikoa korronte elektrikoko sistema baten zirkulazio itxia da. Adibide bat korronte konstantea duen alanbre-begizta bakarra da.[3][4]
Dipoloak elektrikoak zein magnetikoak izan, momentu dipolarra dute ezaugarri, hau da, bektore-kantitate bat. Dipolo elektriko bakunaren kasuan, momentu dipolar elektrikoak karga negatibotik karga positibora du norabidea eta haren magnitudea karga bakoitzaren indarra eta kargen arteko tartearen biderketa da. Zehazteko: momentu dipolarra definitzean beti hartu behar da kontuan "muga dipoloa", non karga sortzaileek 0ra konbergitu behar duten eta, aldi berean, kargaren indarrak infinituraino dibergitu behar duen, horrela, produktua konstante positibo bezala mantentzeko.
Korronte magnetikoaren begiztarentzat (dipoloa), momentu dipolar magnetikoa begizta zuloan zehar doa (eskuineko eskuaren arauaren arabera), eta begiztan dagoen korrontearen magnitude bera du begiztaren azaleragatik biderkatuta.

Korronte magnetikoko begizten antzera, elektroi-partikulak eta beste oinarrizko partikula batzuek momentu dipolar magnetikoak dituzte, elektroi batek korronte-begizta oso txiki batek sortutako eremu magnetiko bera sortzen baitu.[5] Hala ere, elektroi baten momentu dipolar magnetikoa ez da korronte-begizta batengatik, baizik eta elektroiaren propietate intrintseko batengatik.
Iman iraunkor batek elektroien berezko momentu dipolar magnetikoari esker lortzen du bere magnetismoa. Barra magnetiko baten bi muturrak poloak dira (ez nahastu monopoloekin) eta "iparraldea" eta "hegoaldea" bezala bereizten dira. Lurraren eremu magnetikoari dagokionez, barra magnetikoaren polo bakoitzak Lurraren polo bakoitzera joko luke: iparrak iparburua eta hegoak hegoburura, hurrenez hurren. Barra magnetikoaren momentu dipolarrak bere hego magnetikotik ipar polo magnetikora seinalatzen du. Iparrorratz magnetiko batean, barrako iman baten ipar poloa iparraldera begira dago. Halaber, horrek esan nahi du Lurreko ipar polo geomagnetikoa bere momentu dipolarreko hego poloa dela, eta alderantziz.
Dipolo magnetikoak sortzeko ezagutzen diren mekanismo bakarrak korronte-begiztak edo spin mekaniko kuantikoa dira, monopolo magnetikoak inoiz ez baitira esperimentalki frogatu.
Sailkapena



Dipolo fisiko batek bi karga puntual berdin eta kontrajarri ditu: adiera literalean, bi polo. Distantzia handietako eremua (hau da, poloen arteko tartearekin alderatuta) lehen definitutako momentu dipolarraren mende dago erabat. Dipolo (elektriko) puntual bat momentu dipolarra konstante mantenduz eta poloen arteko distantzia 0ra eramanez lortzen den muga da. Dipolo puntual baten eremuak forma bereziki sinplea du, eta hedapen multipolarreko 1. ordenako terminoa, hain zuzen, eremu dipolo puntuala da.
Naturan monopolo magnetikorik ezagutzen ez den arren, elektroiak bezalako partikulei erlazionatutako spin mekaniko kuantiko baten moduan existitzen dira dipolo magnetikoak (nahiz eta efektu horien deskribapen zehatza elektromagnetismo klasikotik kanpo geratu). Puntu magnetiko teorikoko dipolo batek eremu magnetiko bat du, puntu elektrikoko dipolo baten eremu elektrikoaren modu berean.
Dipolo molekularrak
Molekula askok momentu dipolarrak dituzte atomo ezberdinen karga positibo eta negatiboen banaketa ez-uniformeengatik. Hala gertatzen da hidrogeno fluoruroa (HF) bezalako konposatu polarretan, non elektroi-dentsitatea atomoen artean modu desberdinean partekatzen den. Hori dela eta, molekula baten dipoloa berezko eremu elektrikoa duen dipolo elektrikoa da, eremu magnetikoa sortzen duen dipolo magnetiko batekin nahastu behar ez dena.
Peter J. W. Debye kimikari fisikoa izan zen dipolo molekularrak sakon aztertu zituen lehen zientzialaria eta, ondorioz, dipolo momentuak bere omenez debye izeneko unitateetan neurtzen dira.
Molekulentzat hiru dipolo mota daude:
Dipolo iraunkorrak
Molekula bateko bi atomoek elektronegatibitate nabarmen desberdina dutenean gertatzen dira: atomo bateko elektroiak besteak baino gehiago erakartzen ditu, negatiboago bihurtuz eta beste atomoa positiboagoa izango da. Momentu dipolar iraunkorra duen molekulari molekula polar deritzo.
Berehalako dipoloak
Hauek kausalitatearen ondorioz gertatzen dira elektroiak leku batean molekula batean bestean baino gehiago kontzentratuta daudenean, aldi baterako dipolo bat sortuz.
Induzitutako dipoloak
Hauek dipolo iraunkor bat duen molekula batek beste molekula bateko elektroiak uxatzen dituenean gerta daitezke, molekula horretan momentu dipolo bat eraginez. Molekula bat polarizatu egiten da induzitutako dipolo bat daramanean.
Orokorrean, ρ edozein karga-banaketa polarizagarriko dipolo induzitua ρ-tik kanpoko eremu elektriko batek eragiten du. Eremu hau, adibidez, ρ-ren inguruko molekula polar batetik sor daiteke. Momentu dipolar induzituaren tamaina kanpoko eremuaren indarraren eta ρ-ren dipoloaren polarizagarritasunaren biderkaduraren berdina da.
Momentu dipolarren balioak konstante dielektrikoaren neurketatik lor daitezke. Hauek dira gas fasearen ohiko balio batzuk debye unitateetan:

- karbono dioxidoa: 0
- karbono monoxidoa 0,112D
- ozonoa: 0.53D
- fosgenoa: 1,17D
- ur lurruna: 1,85D
- hidrogeno zianuroa: 2,98D
- zianamida: 4.27D
- potasio bromuroa: 10,41D
Potasio bromuroak (KBr) momentu dipolar handienetakoa du gas fasean molekula gisa dagoen konposatu ioniko bat delako.

Molekula baten momentu dipolar orokorra lotura-momentu dipoloen bektoreen batuketen hurbilketa bezala adierazi daiteke. Bektoreen batuketa izanik, hauen orientazio erlatiboaren menpe dago; era horretan dipoloen geometriari buruzko informazioa lortu daiteke.
Adibidez, CO2-aren dipolo balioa zero izateak C=O lotura momentu dipolarrak elkar ezeztatzen direla adierazten du molekula lineala dela berretziz. H2O-rako, O−H loturak ez dira ezeztatzen, molekula angulo batean tolestuta dagoelako.
Dipolo elektriko baten eremua
Jatorrian dagoen dipolo elektriko batek r distantzian duen potentzial elektrostatikoa honako hau da:
Non p momentu dipolarra den eta є0 permitibitate absolutua.
Termino hau potentzial elektrostatiko arbitrario baten polo anitzeko garapenean bigarren termino gisa agertzen da Φ(r). Φ(r)-en iturria dipolo bat bada, termino hori da Φ(r)-ren polo anitzeko garapenean desagertuko ez den termino bakarra. Dipolo baten eremu elektrikoa potentzial horren gradientetik abiatuta aurki daiteke[6]:
Erreferentziak
- δίς, Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
- «dipole, n.». Oxford English Dictionary (second edición). Oxford University Press. 1989.
- Charles A., Brau. Modern Problems in Classical Electrodynamics. Oxford University Press ISBN 0-19-514665-4..
- David J., Griffiths. (1999). Introduction to Electrodynamics. Prentice Hall ISBN 0-13-805326-X..
- David J., Griffiths. (1994). Introduction to Quantum Mechanics. Prentice Hall ISBN 978-0-13-124405-4..
- John D., Jackson. (1999). Classical Electrodynamics, 3rd Ed.. Wiley ISBN 978-0-471-30932-1..
Ikus, gainera
- Polarizazio dentsitate
- Electret
- Monopolo