| Trietila fosfito | |||||
| Kemia formulo | |||||
3.png.webp) | |||||
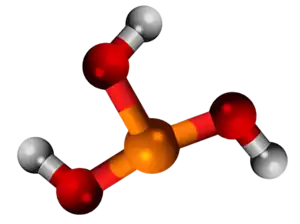
Trietila fosfito | |||||
 | |||||
| Alternativa(j) nomo(j) | |||||
| CAS-numero-kodo | 122-52-1 | ||||
| ChemSpider kodo | 28956 | ||||
| PubChem-kodo | 311215 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora, lumsensiva likvaĵo kun malbona odoro[1] | ||||
| Molmaso | 166,157g mol−1[2] | ||||
| Denseco | 0,969 g/cm−3[3] | ||||
| Fandpunkto | -112°C [4] | ||||
| Bolpunkto | 159,8°C [5] | ||||
| Refrakta indico | 1,4130 | ||||
| Ekflama temperaturo | 54,1°C [6] | ||||
| Solvebleco | Akvo:malmulte solvebla[7] | ||||
| Mortiga dozo (LD50) | >2000 mg/kg (buŝe) | ||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H226, H302, H312, H315, H318, H319, H332, H335, H361 | ||||
| GHS Deklaroj pri antaŭgardoj | P203, P210, P233, P240, P241, P242, P243, P261, P264, P264+265, P270, P271, P280, P301+317, P302+352, P303+361+353, P304+340, P305+351+338, P305+354+338, P317, P318, P319, P321, P330, P332+317, P337+317, P362+364, P370+378, P403+233, P403+235 | ||||
(25 °C kaj 100 kPa) | |||||
Trietila fosfito aŭ trietila fosfito estas organika kombinaĵo rezultanta el interagado de la etanolo kaj hipofosfita acido. Ĝi estas senkolora, lumsensiva likvaĵo kun malbona odoro, malmulte solvebla en akvo, sed solvebla en etanolo, kloroformo kaj nepolaraj organikaj solvantoj. Trietila fosfito posedas 6 karbonatomojn, 15 hidrogenatomojn, 1 fosforatomon kaj 3 oksigenatomojn. Trietila fosfito uzatas en kemiaj sintezoj kaj en la preparado de fosfitaĵoj. Malkomponiĝas sub hejtado kaj brulado. Ĉi tio produktas toksajn vaporojn inkluzive de fosforaj oksidoj. Reakcias kun akvo, acidoj kaj fortaj oksidantoj. Ĉi tio kreas danĝeron de fajro kaj eksplodo.
Sintezoj
Sintezo 1
- Preparado per agado de fosfita acido kaj etila alkoholo:
|
|
Sintezo 2
- Preparado per traktado de fosforila triklorido kaj etila alkoholo:
|
|
Sintezo 3
- Preparado per reakcio de etila klorido kaj fosfita acido:
|
|
Sintezo 4
- Preparado per interagado de etila klorido kaj natria fosfito:
|
|
Vidu ankaŭ
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.