| Tiokarbamido | ||||
 | ||||
| Plata kemia strukturo de la Tioureo | ||||
 | ||||
| Tridimensia strukturo de la Tioureo | ||||
 | ||||
| Taŭtomera strukturo de la Tioureo | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 62-56-6 | |||
| ChemSpider kodo | 2005981 | |||
| PubChem-kodo | 2723790 | |||
| Merck Index | 15,9521 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blanka solido[1] | |||
| Molmaso | 76.12 g·mol-1 | |||
| Denseco | 1.405 g cm−3 | |||
| Fandpunkto | 182 °C | |||
| Bolpunkto | 186 °C - sublimiĝas | |||
| Ekflama temperaturo | 66,8 °C[2] | |||
| Memsparka temperaturo | 440 °C | |||
| Acideco (pKa) | 13.87 | |||
| Solvebleco | Akvo:142 g/L (25°C ) | |||
| Mortiga dozo (LD50) | 125 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Risko | R22 R38 R40 R43 R51/53 R63 | |||
| Sekureco | S36/37 S61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[3] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Averto | |||
| GHS Deklaroj pri damaĝoj | H302, H351, H361d, H411 | |||
| GHS Deklaroj pri antaŭgardoj | P201, P273, P301+312, P308+313, P330, P391, P501 | |||
(25 °C kaj 100 kPa) | ||||
Tioureo aŭ tiokarbamido estas organika kombinaĵo kun sama strukturo de la ureo kie la oksigenatomo estis anstataŭita de sulfuratomo. Tiel kiel la ureo, ĝin eblas prepari kreante komponaĵon kun identa kemia komponado pere de rearanĝaj reakcioj, tiel kiel varmigante amonian tiocianaton pli alta ol 170°C.
Tioureo elmontras multe da kemiaj proprecoj de la ureo, sed ĝi havas malmulte da industriaj uzoj. Tioureo uzatas kiel insekticido, akaricido, plastaj manufakturoj, fotografiaj kaj fotokopiaj procezoj kaj akceliloj en la produktado de sinteza kaŭĉuko.
En akva solvaĵo ĝi facile hidroliziĝas al amoniako, karbona duoksido kaj hidrogena sulfido. Sub varmigado malsupra ol ĝia fandopunkto, tioureo transformiĝas en amonia tiocianato. Ĝi facile oksidiĝas en ĉeesto de kalia permanganato.
Sintezoj
Sintezo 1
- Tioureo estiĝas per fando de amonia tiocianato supera al 170-180°C

Sintezo 2
- Tioureo estiĝas per traktado de la amoniako kun karbona dusulfido:
Sintezo 3
- Tioureo ankaŭ prepareblas per interagado de la amonia sulfido kun kalcia cianido en akva solvaĵo:
Sintezo 4
- Tioureo sintezeblas per interagado de la cianamido kaj hidrogena sulfido:

Reakcio
- Tioureo facile oksidiĝas al tiourea oksido en ĉeesto de hidrogena peroksido aŭ kalia permanganato:

Literaturo
- Chemical Book
- Chemicalland21
- Encyclopedia of Food and Color Additives, Volume 1, George A. Burdock
- Sodium Dithionite, Rongalite and Thiourea Oxides: Chemistry and Application, Sergei V Makarov, Attila kaj Horváth, Radu Silaghi-Dumitrescu, Qingyu Gao
- The Chemistry of Gold Extraction, John Marsden, Iain House
- Advances in Thiourea Research and Application: 2011 Edition: ScholarlyPaper
Kunrilataj kemiaĵoj

Dufenila ureo 
Tiourea duoksido 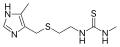
Metiamido 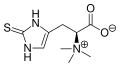
Ergotionejno 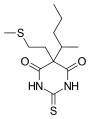
Metituralo 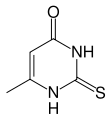
Metiltiouracilo
Vidu ankaŭ
Referencoj
- ↑ Van Nostrand’s Scientific Encyclopedia, Douglas M. Considine, Glenn D. Considine
- ↑ Shandong Efirm Biochemistry Environmental Protection Co. LTD. Arkivita el la originalo je 2021-12-29. Alirita 2021-12-29.
- ↑ Sigma Aldrich




