| Tiolaktata anhidrido | |||
| Kemia formulo | |||
 | |||
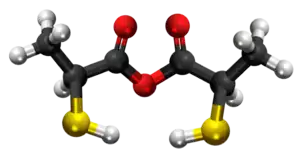
Tiolaktata anhidrido | |||
 | |||
| Alternativa(j) nomo(j) | |||
β-Merkaptolaktata anihdrido | |||
| Fizikaj proprecoj | |||
| Aspekto | blanka solidaĵo | ||
| Molmaso | 178,209g mol−1[1] | ||
| Solvebleco | Akvo:solvebla | ||
| Mortiga dozo (LD50) | >500 mg/kg (buŝe) | ||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H226, H315, H319, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P261, P264, P264+265, P271, P280, P302+352, P303+361+353, P304+340, P305+351+338, P319, P321, P332+317, P337+317, P362+364, P370+378, P403+233, P403+235, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
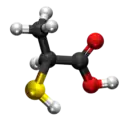
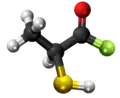
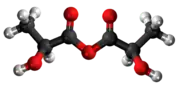
Tiolaktata anhidrido aŭ 2-merkaptolaktata anhidrido estas organika kombinaĵo rezultanta per senhidratigo de la tiolaktata acido en ĉeesto de fosfora pentaoksido. Ĝi estas blanka solidaĵo, nesolvebla en akvo. Tiolaktata anhidrido posedas 6 karbonatomojn, 10 hidrogenatomojn, 1 sulfuratomon, kaj 4 oksigenatomojn. Tiolaktata anhidrido uzatas en kemiaj sintezoj kaj en la preparado de tiolaktataj derivaĵoj.
Sintezoj
Sintezo 1
- Preparado de la per traktado de tiolaktata acido kaj tiolaktata anhidrido:
|
|
Sintezo 2
- Preparado de la tiolaktata anhidrido per traktado de tiolaktoila klorido kaj tiolaktata acido:
|
|
Sintezo 3
- Preparado de la tiolaktata anhidrido per traktado de laktata anhidrido kaj sulfida acido:
|
|
Sintezo 4
- Preparado de la tiolaktata anhidrido per traktado de laktata anhidrido kaj fosfora pentasulfido:
|
|
Vidu ankaŭ
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.