| Sulfura trioksido | |||||
 | |||||
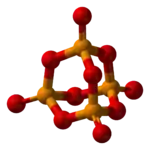
| Plata kemia strukturo de la Sulfura trioksido | |||||
 | |||||
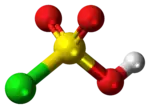
| Tridimensia kemia strukturo de la Sulfura trioksido | |||||
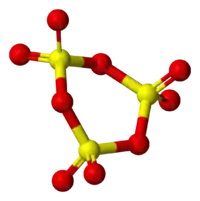 | |||||
| Kiam kondensitaj, tiam la molekuloj de sulfura trioksido formas trimerojn, konatajn kiel γ-SO3.[1] | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 7446-11-9 | ||||
| ChemSpider kodo | 23080 | ||||
| PubChem-kodo | 24682 | ||||
| Merck Index | 15,9109 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora likvaĵo aŭ blanka fumeganta toksa solidaĵo | ||||
| Molmaso | 80,057 g·mol−1 | ||||
| Denseco | 1,9224g cm−3 | ||||
| Fandpunkto | 16,9 °C | ||||
| Bolpunkto | 32,5 °C (β-formo) 62,3 °C (α-formo) | ||||
| Ekflama temperaturo | Nebrulema | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 375 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R14 R35 R37 | ||||
| Sekureco | S1/2 S26 S30 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H314, H318, H335 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P261, P264, P271, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P403+233, P405, P501[2] | ||||
(25 °C kaj 100 kPa) | |||||
Sulfura trioksido aŭ SO3 estas neorganika oksigena kombinaĵo de sulfuro, senkolora likvaĵo (pro ĝia malalta fandpunkto) aŭ blanka fumeganta toksa solidaĵo, kiu sub la gasa formo reprezentas maltrankviligan polucion kaj primara agento de la acidaj pluvoj. Ĝi estas produktata en industria skalo kiel antaŭaĵo de la sulfata acido. Ĝiaj vaporoj estas odorosenaj sed treege korodaj. La solida naturo de la sulfura trioksido estas kompleksa ĉar strukturaj modifoj okazas pro la ĉeesto de akvo-spuroj.
Sintezoj
Sintezo 1
- Preparado per rekta interagado de sulfura duoksido kun oksigeno:
|
2 |
Sintezo 2
- Preparado per pirolizo de natria bisulfito:
|
2 |
Sintezo 3
- Preparado per traktado de fera (II) sulfido kaj oksigeno:
|
|
Sintezo 4
- Fera (III) sulfato estas verda solidaĵo kiu tamen per varmigo donas feran (III) oksidon (duonruĝan-brunkoloran) kaj sulfuran trioksidon kun penetranta odoro:
|
|
Reakcioj
Reakcio 1
- Preparado de sulfata acido per traktado de sulfura trioksido kaj akvo:
|
|
Reakcio 2
- Sulfura trioksido reakcias kun sulfura duklorido por doni tionilan kloridon kaj sulfuran duoksidon:
|
|
Reakcio 3
- Preparado de fosfora kvinoksido per traktado de sulfura trioksido kun la kemia elemento fosforo:
|
10 |
Reakcio 4
- Preparado de klorosulfata acido per interagado de klorida acido kaj sulfura trioksido]]:
|
|
Reakcio 5
- Sintezo de tionila klorido per interagado de sulfura trioksido, kloro kaj sulfura duklorido:
|
|
Literaturo
- Cameo Chemicals
- Strukturo de Lewis Youtube
- NIST National Institute of Standards and Technology
- Handbook of Corrosion Data
- Oleochemical Manufacture and Applications
- Inorganic Chemistry
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.






_sulfide.png.webp)

-sulfate-3D-balls-ionic.png.webp)