| Pirofosfata acido | |||
| Kemia formulo | |||
 | |||
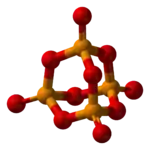
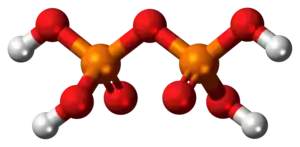
Pirofosfata acido | |||
 | |||
| Alternativa(j) nomo(j) | |||
| |||
| CAS-numero-kodo | 2466-09-3 | ||
| ChemSpider kodo | 996 | ||
| PubChem-kodo | 1023 | ||
| Fizikaj proprecoj | |||
| Aspekto | blanka, higroskopa solidaĵo[1][2] | ||
| Molmaso | 177,973g mol−1 | ||
| Denseco | 2,43 g/cm−3[3] | ||
| Fandpunkto | 61°C [4][5] | ||
| Bolpunkto | 480°C [6] | ||
| Refrakta indico | 1,5600 | ||
| Solvebleco | Akvo:solvebla Solvebla en etanolo kaj eteroj. | ||
| Mortiga dozo (LD50) | 1160 mg/kg (buŝe)[7] | ||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H302, H314, H318 | ||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P264+265, P270, P280, P301+317, P301+330+331, P302+361+354, P304+340, P305+354+338, P316, P317, P321, P330, P363, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Pirofosfata acido aŭ pirofosfata acido estas organika kombinaĵo rezultanta per hidrolizo de la fosfora pentaoksido. Ĝi estas blanka, senodora, higroskopa solidaĵo, solvebla en akvo, etanolo, eteroj kaj aliaj nepolaraj organikaj solvantoj. Pirofosfata acido posedas 4 hidrogenatomojn, 2 fosforatomojn, 1 kaj 7 oksigenatomojn. Pirofosfata acido uzatas en kemiaj sintezoj kaj en la preparado de pirofosfataj derivaĵoj.
Sintezoj
Sintezo 1
- Preparado de la pirofosfata acido per hidrolizo kun pirofosfata anhidrido :
|
|
Sintezo 2
- Preparado de la pirofosfata acido per traktado de fosfata acido kaj fosforila klorido:
|
5 |
Sintezo 3
- Preparado de la pirofosfata acido per malkomponado de fosfata acido:
|
2 |
Sintezo 4
- Preparado de la pirofosfata acido per traktado de amonia pirofosfato kaj karbonata acido en solida fazo. En akvaj solvaĵoj la pirofosfatoj estas malstabilaj.:
|
|
Vidu ankaŭ
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.