| Pirano | |||
 | |||
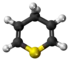
| Plata kemia strukturo de la 4H-Pirano | |||
 | |||
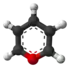
| Tridimensia kemia strukturo de la 4H-Pirano | |||
| Kemia formulo | |||
| CAS-numero-kodo | 289-65-6 | ||
| ChemSpider kodo | 119912 | ||
| PubChem-kodo | 136135 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora aŭ flaveca likvaĵo kun malagrabla odoro | ||
| Molmaso | 82,102 g·mol-1 | ||
| Denseco | 0,922g cm−3 | ||
| Fandpunkto | -70°C[1] | ||
| Bolpunkto | 86°C[2] | ||
| Ekflama temperaturo | -16 °C | ||
| Memsparka temperaturo | 240 °C | ||
| Solvebleco | Akvo:20 g/L [3] | ||
| Mortiga dozo (LD50) | >3980 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R11 R19 R36/38 R20 | ||
| Sekureco | S16 S29 S43 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H225, H315, H319, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P240, P241, P242, P243, P280, P370+378 | ||
(25 °C kaj 100 kPa) | |||
Pirano aŭ C5H6O estas estas sesmembra heterocikla kombinaĵo, ne-aromata-ringo, konsistanta je kvin karbonatomoj kaj unu oksigenatomo kaj enhavanta du duoblajn ligilojn. Ekzistas du geometriaj izomeroj kun la sama kemia formulo kies diferencoj sidas sur la loko de la duoblaj ligiloj (2H-pirano, kaj 4H-pirano).
4H-pirano estis unue sintezita kaj karakterizita en 1962 kaj oni malkovris ke ĝi estas tre malstabila. 4H-pirano, cetere, facile disproporcias al la saturitaj korespondaj duhidropirano kaj piraniliuma jono. Kvankam ili ne estas tiel signifoplenaj en kemio, biologie multaj el ĝiaj derivaĵoj plenumas gravajn reakciojn, tiaj kial la piranoflavonoidoj.
La vorto pirano ofte aplikiĝas al la saturitringa analogaĵo, pli adekvate raportita kiel kvarhidropirano aŭ oksano. Cetere, la unusakaridoj enhavantaj sesmembra ringosistemo estas konataj kiel piranozoj.
Sintezoj
Sintezo 1
- Per oksidigo de la duhidropirano:
|
|
Sintezo 2
- Per oksidigo de la kvarhidropirano:
|
|
Sintezo 3
- Per molekula rearanĝo de la ciklopentenono:
|
|
Reakcioj
Reakcio 1
- Preparado de 3-piranono per oksidigo kun kalia permanganato:
|
|
Reakcio 2
- Reakcio kun acetata acido:[4]
|
|
Reakcio 3
- Preparado per reduktado de la kvarhidropirano:
|
|
Reakcio 4
- Preparado de la piranolo:
|
2 |
Reakcio 5
- Preparado de duhidropirano per reduktigo de la pirano:
|
|
Reakcio 6
- Preparado de tiopirano: [5]
|
|
Reakcio 7
- Pirano facile hidroliziĝas al piraniliuma jono:
|
|
Literaturo
- Heterocycles in Natural Product Synthesis
- Science of Synthesis: Houben-Weyl Methods of Molecular Transformations
- Index Volume
- Immunosuppression and Human Malignancy
- Fenaroli's Handbook of Flavor Ingredients
- Science of Synthesis: Cross Coupling and Heck-Type Reactions
- Pharmaceutical Substances
- Organic Chemistry