| Nitrozila fluorido | |||||
 | |||||
| Plata kemia strukturo de la Nitrozila fluorido | |||||
 | |||||
| Tridimensia kemia strukturo de la Nitrozila fluorido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 7789-25-5 | ||||
| ChemSpider kodo | 109874 | ||||
| PubChem-kodo | 123261 | ||||
| Merck Index | 15,6734 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora, toksa, irita, tre reakciema gaso kun oksidigaj proprecoj | ||||
| Molmaso | 49,004 g·mol-1 | ||||
| Denseco | 1,326g cm−3 | ||||
| Fandpunkto | -132,5°C | ||||
| Bolpunkto | -59,9°C | ||||
| Refrakta indico | 1,279 | ||||
| Ekflama temperaturo | Nebrulema | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 45 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R26 R45 R61 | ||||
| Sekureco | S14 S34 S37 S50 S45 S53 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H220, H280, H314, H330, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P260, P264, P271, P273, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P363, P377, P381, P391, P403, P403+233, P405, P410+403, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Nitrozila fluorido aŭ NOF estas neorganika fluora kombinaĵo de nitrogeno kaj oksigeno, senkolora, toksa, irita, tre reakciema gaso kun oksidigaj proprecoj, fluorigagento kiu konvertas multajn metalojn al ties respektivaj fluoridoj, liberigante nitratan oksidon en la procezo kaj partoprenante en sennombraj kemiaj sintezoj. Nitrozila fluorido konvertas aromatajn alkoholojn en nitritojn kaj uzatas kiel solvanto kaj oksidiganto por raketo-brulaĵo,
Sintezoj ekde nitrogenaj oksidoj kaj fluoro
Sintezo 1Sintezo 2Sintezo 3Sintezo 4Sintezo 5Sintezo 6Sintezo 7 |
Sintezoj ekde nitrogenaj oksidoj kaj fluorida acido
Sintezo 8Sintezo 9Sintezo 10Sintezo 11Sintezo 12Sintezo 13Sintezo 14 |
Aliaj sintezoj
Sintezo 15
- Preparado per agado de nitrata acido sur kalia fluorido:[1]
|
|
Sintezo 16
- Preparado per interagado kun arĝenta (I) fluorido:
|
|
Reakcioj
Reakcio 1
- NItrozila fluorido malkomponiĝas per fotolizo:
|
2 |
Reakcio 2
- Per hidrolizo ĝi iĝas en fluorida acidon kaj nitritan acidon:
|
|
Reakcio 3
- Preparado de nitrila fluorido per reakcio kun ozono:
|
|
Reakcio 4
- Preparado de fosfora kvinoksido per interagado kun fosforo:
|
5 |
Reakcio 5
- Sintezo de nitrozilsulfata acido per reakcio kun sulfura trioksido en akva medio:
|
|
Reakcio 6
- Sintezo de silicia kvarfluorido per traktado kun silicia oksido:
|
4 |
Reakcio 7
- Preparado de sulfura kvarfluorido per interagado kun sulfura duklorido:
|
4 |
Reakcio 8
- Sintezo de sulfura heksafluoro per traktado kun sulfuro-kvinfluora klorido:[2]
|
2 |
Reakcio 9
- Sintezo de karbona kvarfluorido per interagado kun karbona dusulfido:
|
4 |
Reakcio 10
- Preparado de nitrozila klorido per interagado kun aluminia triklorido:
|
3 |
Reakcio 11
- Formado de kobalta (III) kompleksaĵo per interagado de nitrozila fluorido, natria fluorido kaj kobalto:
|
3 |
Reakcio 12
- Preparado de nitrometano per agado sur metanolo:
|
|
Reakcio 13
- Sintezo de nitrozo-benzeno en ĉeesto de nitrozila fluorido kaj benzeno:
|
|
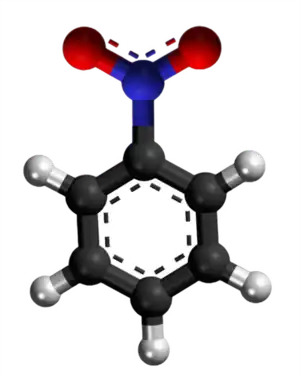
Reakcio 14
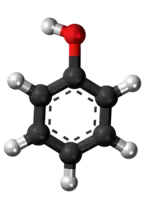
- Preparado de nitrobenzeno per agado de nitrozila fluorido sur fenolo:
|
|
Vidu ankaŭ
Literaturo
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.