| Nitrozila bromido | |||||
 | |||||
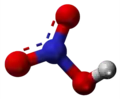
| Plata kemia strukturo de la Nitrozila bromido | |||||
 | |||||
| Tridimensia kemia strukturo de la Nitrozila bromido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 13444-87-6 | ||||
| ChemSpider kodo | 109908 | ||||
| PubChem-kodo | 123304 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | malhelruĝa gaso kun penetranta odoro kaj oksidigaj proprecoj | ||||
| Molmaso | 109,91 g·mol-1 | ||||
| Denseco | 2,637 (20°C )g cm−3 | ||||
| Fandpunkto | -56°C | ||||
| Bolpunkto | 14,5°C | ||||
| Refrakta indico | 1,524 | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 50 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R14 R34 R37 | ||||
| Sekureco | S26 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H314, H335 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P261, P264, P271, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P403+233, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Nitrozila bromido aŭ NOBr estas neorganika broma kombinaĵo de nitrogeno kaj oksigeno, malhelruĝa gaso kun penetranta odoro kaj oksidigaj proprecoj kies kondensiga punkto estas iom malsupre ol media temperaturo. Sammaniere kiel kun nitrozila klorido kaj nitrozila fluorido, ĝi uzatas en kemiaj sintezoj ĉar en akva medio ĝi iĝas en bromidan acidon kaj nitratan acidon kondiĉigante al bromigaj kaj nitrogenigaj reakcioj. En normalaj kondiĉoj ĝi malkomponiĝas per fotolizo formante nitratan oksidon kaj klorgason.
Sintezoj
Sintezo 1
- Sintezo de nitrozila bromido per interagado de la bazaj kemiaj elementoj:
|
2 |
Sintezo 2
- Sintezo per traktado de nitrogena duoksido kaj bromo:
|
2 |
Sintezo 3
- Preparado per traktado de nitrogena duoksido kaj kalia bromido:
|
2 |
Sintezo 4
- Preparado de nitrozila bromido per interagado de dunitrogena trioksido kaj bromo:
|
2 |
Sintezo 5
- Per reakcio inter nitrita acido kaj bromida acido:
|
|
Sintezo 6
- Sintezo per traktado de nitrata acido kaj bromida acido:
|
2 |
Sintezo 7
- Per interagado de nitrozila klorido kaj bromida acido:
|
|
Sintezo 8
- Per reakcio inter natria nitrito kah bromo:
|
2 |
Sintezo 9
- Per traktado de natria nitrito kaj bromida acido:[1]
|
|
Sintezo 10
- Per interagado de nitrozilsulfata acido kaj natria bromido:
|
|
Reakcioj
Reakcio 1
- Malkomponado de nitrozila bromido:[2]
|
2 |
Reakcio 2
- Per hidrolizo, nitrozila bromido iĝas en nitratan acidon, nitratan oksidon kaj bromidan acidon:
|
3 |
Reakcio 3
- Nitrozila bromido reakcias kun kalia hidroksido:
|
4 |
Reakcio 4
- Kun metanolo ĝi donas nitrometanon:
|
|
Reakcio 5
- Kun metilamino ĝi iĝas en bromometanon:
|
|
Reakcio 6
|
|
Reakcio 7
- Preparado de tribromoacetata acido per reakcio kun trifluoroacetata acido:
|
3 |
Reakcio 8
- Sintezo de nitrozila klorido en ĉeesto de klorgaso:
|
2 |
Reakcio 9
- Preparado de nitrozobenzeno per agado sur fenil-natrio:
|
|
Reakcio 10
|
2 |
Reakcio 11
- Preparado de nitrozilsulfata acido per agado sur arĝenta bisulfato:
|
|
Vidu ankaŭ
Literaturo
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.