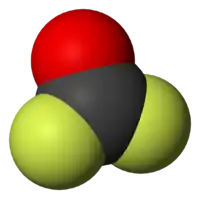
| Nitrogena duoksido | |||||
 | |||||
| Plata kemia strukturo de la Nitrogena dioksido | |||||
 | |||||
| Tridimensia kemia strukturo de la Nitrogena dioksido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 10102-44-0 | ||||
| ChemSpider kodo | 2297499 | ||||
| PubChem-kodo | 3032552 | ||||
| Merck Index | 15,6690 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | toksa, irita, venena, koroda, oksidiga, alte reakciema, ruĝbruna gaso kun penetranta klorsimila odoro | ||||
| Molmaso | 46,005 g·mol-1 | ||||
| Denseco | 3,3g cm−3 | ||||
| Fandpunkto | -11,2°C | ||||
| Bolpunkto | 21,1°C | ||||
| Refrakta indico | 1,449 | ||||
| Solvebleco | Akvo:reakcias | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R26 R34 | ||||
| Sekureco | S9 S26 S28 S36/37/39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H270, H280, H319, H330, H336, H361, H370, H372 | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P220, P244, P260, P261, P264, P270, P271, P280, P281, P284, P304+340, P305+351+338, P308+313, P310, P314, P320, P321, P337+313, P370+376, P403, P403+233, P405, P410+403, P501[2] | ||||
(25 °C kaj 100 kPa) | |||||
Nitrogena dioksido, aŭ foje nitrogena duoksido, (molekula formulo NO2) estas neorganika nitrogena kombinaĵo de oksigeno, toksa, venena, ruĝbruna gaso kun klorsimila odoro, kiu reakcias kun la atmosfero por formi nitratan acidon, kontribuante por generado de la acida pluvo. Ĝi estas respondeca pri kaŭzado de fluidaĵo-akumuliĝo en la pulmoj. Krom tio, nitrogena dioksido plenumas rolon en la formado de fotokemia fumnebulo, ia duonruĝe bruna atmosfera kondiĉo tre ofte vidata en urbareoj kaj kreita de agado de la sunlumo al sur la malalta atmosfero.
Proprecoj
Nitrogena dioksido estas grava atmosfera spurgaso, ne nur pro ĝia efiko sur la sano sed pro tio, ke ĝi sorbas videblan sunradiadon kaj kontribuas por malhelpado de atmosfera videbleco, ĝi estas sorbanto de videbla radiado kaj pro tio ĝi plenumas senperan rolon en la modifo de la globa sistemo tiam kiam ĝiaj koncentriĝoj estas treege altaj, kaj kune kun nitrata oksido, ĝi estas ĉefa reguliganto de la oksidiga kapableco de la libertroposfero per kontrolado de akumuliĝo kaj efiko de la liberradikaloj, inklude de la hidroksilaj radikaloj, kaj finfine ĝi plenumas decidan rolon en la determinado de ozonaj koncentriĝoj en la troposfero pro tio ke la fotolizo de la nitrogena duoksido estas la plej grava iniciatinto de la fotokemia ozono-formiĝo kaj en nepoluciitaj kaj en poluciitaj atmosferoj.[3]
Nitrogena dioksido estas pli densa ol aero kaj estas solvebla en karbona kvarklorido, nitrata acido, sulfata acido kaj kloroformo. Nitrogena duoksido eksplode reakcias kun metaloj, organikaj substancoj, alkoholoj, aldehidoj, acetonitrilo, dumetil-sulfuroksido, hidrokarbonidoj kaj hidroksidoj.
Sintezoj
Sintezo 1
- Preparado ekde plumba (II) nitrato:
|
2 |
Sintezo 2
- Preparado ekde zinka nitrato:
|
|
Sintezo 3
- Preparado per interagado de kupro kaj nitrata acido:
|
|
Sintezo 4
- Preparado per traktado de acetata acido kaj nitrata acido:
|
|
Sintezo 5
- Preparado per reakcio inter nitrogena monooksido kaj oksigeno:
|
2 |
Sintezo 6
- Per interagado de fosfora kvinoksido kaj nitrata acido:[4]
|
2 |
Reakcioj
Reakcio 1
- Dumerigo de la nitrogena dioksido:
|
2 |
Reakcio 2
- Malkomponado de nitrogena dioksido:
|
2 |
Reakcio 3
- Hidrolizo de nitrogena dioksido tiam kiam proporcio NO2/H2O estas 2:1:
|
2 |
Reakcio 4
- Hidrolizo de nitrogena dioksido tiam kiam proporcio NO2/H2O estas 3:1:
|
3 |
Reakcio 5
- Traktado de nitrogena dioksido kaj natria hidroksido:
|
2 |
Reakcio 6
- Reakcio inter nitrogena dioksido kaj hidrogena peroksido:
|
4 |
Reakcio 7
- Oksidigo de karbonatomo:
|
2 |
Reakcio 8
- Oksidigo de fosforo:
|
10 |
Reakcio 9
- Oksidigo de sulfura duoksido:[5]
|
|
Reakcio 10
- Oksidigo de sulfuro:
|
4 |
Reakcio 11
- Oksidigo de kupro:
|
4 |
Reakcio 12
- Oksidigo de klorgaso:
|
2 |
Reakcio 13
- Oksidigo de fluoro:
|
2 |
Reakcio 14
- Osidigo de kobalta (III) fluorido al kobalta (II) fluorido:
|
|
Reakcio 15
- Nitrogena dioksido igas jodidojn en nitritojn:
|
2 |
Reakcio 16
- Transformado de kalia jodido en kalian nitriton:
|
2 |
Literaturo
- Air Quality Guidelines
- Prudent Practices in the Laboratory: Handling and Disposal of Chemicals
- Pollution Prevention and Abatement Handbook
- Pollution: Causes, Effects and Control
- The Chemistry of Nitrogen: Pergamon Texts in Inorganic Chemistry
- Special Report: The Hazards Associated with Agricultural Silo Fires
- Clinical Veterinary Toxicology
- Classic Chemistry Demonstrations
Referencoj
- ↑ https://www.reta-vortaro.de/revo/ Vd nitrogeno-n en ReVo, ĉar la fundamenta vorto "azoto" prefereblas.
- ↑ PubChem
- ↑ Eŭro Who. Arkivita el la originalo je 2017-12-15. Alirita 2018-12-25.
- ↑ BCCampus. Arkivita el la originalo je 2018-12-25. Alirita 2018-12-25.
- ↑ Synthetic Nitrogen Products: A Practical Guide to the Products and Processes







-nitrate-3D-vdW.png.webp)






_fluoride.png.webp)