| Nikela (II) metanato | ||||
| Kemia formulo | ||||
_formate_sticks.png.webp) | ||||
Nikela (II) metanato | ||||
_formate_2D.png.webp) | ||||
Nikela (II) metanato | ||||
_formate.png.webp) | ||||
| Alternativa(j) nomo(j) | ||||
| CAS-numero-kodo | 3349-06-2 | |||
| ChemSpider kodo | 25597 | |||
| PubChem-kodo | 27506 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senodoraj verdaj kristaloj | |||
| Molmaso | 148,7255 g mol−1 | |||
| Denseco | 2,15 g/cm−3[1] | |||
| Fandpunkto | 224 °C [2] | |||
| Solvebleco | Akvo:solvebla Solvebla en etero, acetono, etila acetato, etanolo, malmulte solvebla en benzeno, tolueno kaj ksilolo. | |||
| Mortiga dozo (LD50) | 500 mg/kg (buŝe) | |||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H317, H334, H341, H350, H360, H372, H400, H410 | |||
| GHS Deklaroj pri antaŭgardoj | P203, P233, P260, P261, P264, P270, P271, P272, P273, P280, P284, P302+352, P304+340, P318, P319, P321, P333, P317, P342+316, P362+364, P391, P403, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Nikela (II) formiato aŭ nikela (II) metanato estas organika kombinaĵo rezultanta per traktado de nikela (II) hidroksido kaj formiata acido. Ĝi estas senodoraj verdaj aŭ bluaj kristaloj, solveblaj en akvo kaj etanolo. Nikela (II) formiato posedas 1 nikelatomon, 2 karbonatomojn, 2 hidrogenatomojn kaj 4 oksigenatomojn. Nikela (II) formiato uzatas en kemiaj sintezoj kaj en la preparado de farmaciaĵoj kaj industriaĵoj. Lavu nitratajn jonojn per akvo, sekigu, unue senhidratiĝu je 140 ℃, kaj konservu je 170 ℃ dum 2-3 horoj por plene senhidratiĝi. Je 210 ℃, anhidra nikela formiato malkomponiĝas por liberigi hidrogenon, karbonan duoksidon aŭ nitrogenon por formi aktivan nikelan katalizilon.
Kiel duhidrato, nikela formiato estas verda, senodora, nebrulema solidaĵo, kiu estas malmulte solvebla en akvo. La kunmetaĵo havas monoklinan kristalstrukturon. La anhidrido formiĝas sur zorgema hejtado je 130–140 °C. Se varmigite en vakuo ĝis 300 °C, pura nikelo formiĝas. Nikela formiato estas genotoksa, kaj kelkaj nikelkombinaĵoj pruviĝis aktivi ĉelan proliferadon. Lavu nitratajn jonojn per akvo, sekigu, unue senhidratiĝu je 140 ℃, kaj konservu je 170 ℃ dum 2-3 horoj por plene senhidratiĝi. Je 210 ℃, anhidra nikela formiato malkomponiĝas por liberigi hidrogenon, karbonan duoksidon aŭ nitrogenon por formi aktivan nikelan katalizilon.
Sintezoj
Sintezo 1
- Preparado de la formiata acido per traktado de nikela (II) hidroksido kaj formiata acido:
|
|
Sintezo 2
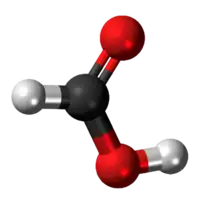
- Preparado de la nikela (II) formiato per traktado de nikela (II) karbonato kaj formiata acido:
|
|
Sintezo 3
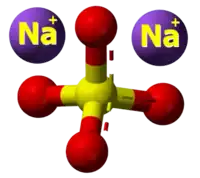
- Preparado de la nikela (II) formiato per traktado de natria formiato kaj nikela (II) sulfato:
|
|
Sintezo 4
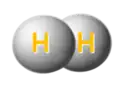
- Nikela formiato (ĉe 260 °C) malkomponiĝas en hidrogeno, karbona duoksido kaj metala nikelo:
|
|



_hydroxyde_3D.png.webp)

_carbonate_3D.png.webp)

_sulfate_3D.png.webp)