| Natria stanato | ||
6.png.webp) | ||
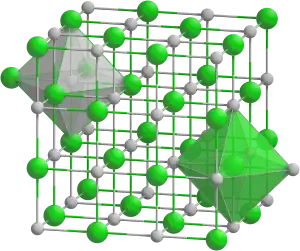
| Kemia strukturo de la Natria stanato | ||
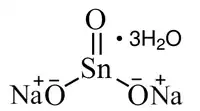 | ||
| Alia kemia strukturo de la Natria stanato | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | 12027-70-2 | |
| PubChem-kodo | 25501 | |
| Fizikaj proprecoj | ||
| Aspekto | Senkolora aŭ blanka solido | |
| Molmaso | 266.73 g mol−1 | |
| Denseco | 4.68 g/cm3 | |
| Fandopunkto | 140 °C | |
| Solvebleco | Akvo:Nesolvebla | |
| Mortiga dozo (LD50) | 2132 mg/kg (muso, buŝa) | |
| Merck Index | 14,8677 | |
| Ekflama temperaturo | 57 °C (135 ℉; 330 K) | |
| Sekurecaj Indikoj | ||
| Risko | R36 R36/37/38 | |
| Sekureco | S26 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj[1] | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P332+313, P304+340, P305+351+338, P337+313, P312, P321, P362+364, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Natria stanato , stanato de natrio aŭ Na2Sn(OH)6 estas neorganika oksokombinaĵo de natrio kaj stano, senkolora salo kiu estiĝas per dissolvado de stano aŭ stana duoksido kaj kaŭstika sodo. Natria stanata uzatas kiel stabiligilo por hidrogena peroksido kaj kiel duonkonduktilo.
Stanatoj troviĝas sub du formoj: metastanatoj prezentantaj la jonon SO3−2 kaj ortostanatoj aŭ SO4−4. Zinka ortostanato estas duonkonduktilo kaj ricevas multe da atento dum la lastaj jardekoj pro ĝia multeuza nivelo de aplikaĵoj.[2]
Sintezo
- Kombinaĵoj de alkalo-metaloj preparata per dissolvado de stano en natria hidroksido:
- Simila reakcio okazas kiam stana duoksido estas traktata per natria hidroksido:
Reakcioj
- Natria stanato malkomponiĝas kiam hejtata:
- Sub altegaj temperaturoj estiĝas stana oksido, natria oksido kaj akvo:
- Ĝi reakcias kune kun diluitaj acidoj:
- Per karbona duoksido, natria karbonato estiĝas:
- Ĝi reakcias per duobla interŝanĝo kun kalcia nitrato:
Proprecoj
La plej granda uzo de neorganikaj stankombinaĵoj estas kiel elektrolito por tavoligo de stano kaj stanaj alojoj. Pro tio, natria stanato uzatas en surfacaj tavoligoj de papero, manufakturo de aliaj metalaj stanatoj kaj elfinaĵoj per stana oksido. Kemie, la stano elmontras valentojn 2 kaj 4; neorganikaj stankombinaĵoj dividiĝas en du serioj: stanozaj aŭ stana (II), kombinaĵoj kiuj enhavas kvaredran elementon, dum la stanikaj aŭ stanaj (IV) estas kombinaĵoj kiuj enhavas stanon kiel duvalentan elementon.[3]
Literaturo
- Sigma Aldrich
- Chemical Book
- Chemicalland21
- Showa America
- American Elements
- Cool Conservation
- Santa Cruz Biotechnology
| ||||||