| Natria oksido | |||
 | |||
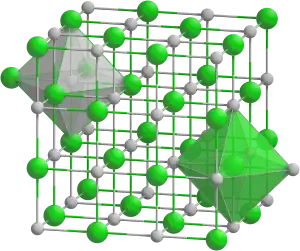
| Tridimensia kemia strukturo de la natria oksido | |||
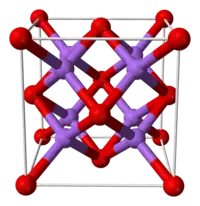 | |||
| Kristala strukturo de natria oksido | |||
| Alternativa(j) nomo(j) | |||
| Oksido de natrio | |||
| Kemia formulo | |||
| CAS-numero-kodo | 1313-59-3 | ||
| PubChem-kodo | 73971 | ||
| ChemSpider kodo | 66599 | ||
| Fizikaj proprecoj | |||
| Aspekto | Blanka solido | ||
| Molmaso | 61.98 g mol−1 | ||
| Denseco | 2,27 g/cm3 | ||
| Fandopunkto | 1,132 °C (2,070 ℉; 1,405 K) | ||
| Bolpunkto | 1,950 °C (3,540 ℉; 2,220 K) sublimiĝas ĉe 1275 °C | ||
| Solvebleco | Akvo:Eksplode reakcias por estigi natrian hidroksidon | ||
| Nesolvebleco | Etanolo: reakcias | ||
| Ekflama temperaturo | Ne bruliva | ||
| Sekurecaj Indikoj | |||
| Risko | R8 R14 R34 R35 | ||
| Sekureco | (S1/2) S8 S26 S27 S36/37/39 S43 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H290, H314, H318, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P234, P260, P261, P264, P271, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P310, P312, P321, P363, P403+233, P404, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Natria oksido, oksido de natrio aŭ Na2O estas neorganika komponaĵo, blanka solido uzata en ceramikoj kaj vitraĵoj. Ĝi estas alkala anhidrido de natria hidroksido, do, kiam akvo aldoniĝas al natria oksido, NaOH produktiĝas.
Sintezoj
Sintezo 1
- Ekde la metalo kun oksigeno:
|
|
Sintezo 2
- Eksceso de natrio estigas natrian oksidon kaj natrian peroksidon:
|
|
Sintezo 3
- Traktado de natria nitrato kaj metala natrio:
|
|
Sintezo 4
- Pura natria oksido estiĝas per agado de natria nitrido kaj natria nitrato:
|
|
Sintezo 5
- Natria hidroksido reakcias kun metala natrio por estigi natrian oksidon kaj hidrogenon:
|
|
Sintezo 6
- Natria peroksido reduktiĝas al natria oksido en la ĉeesto de natrio:[2]
|
|
Sintezo 7
- Natria karbonato estigas natrian oksidon per hejtado:[3]
|
|
Reakcioj
Reakcio 1
- Natria oksido interagas kun akvo por estigi natrian hidroksidon:
|
|
Reakcio 2
- Ĝi reakcias kun karbona duoksido por estigi natrian karbonaton:
|
|
Reakcio 3
- Natria oksido reakcias kun klorida acido por estigi natrian kloridon kaj akvon:
|
|
Reakcio 4
- Natria oksido eksplode reakcias kun acidoj estigante solvaĵojn de la respektivaj saloj:[4]
|
|
YouTube
Literaturo
- American Elements
- Sigma Aldrich
- Learn Chemistry
- Santa Cruz Biotechnology
- Dictionary of Glass: Materials and Techniques, Charles Bray
- How It Works: Science and Technology, Marshall Cavendish Corporation Staff
| ||||||
Referencoj
- ↑ PubChem
- ↑ Peroxides, Superoxides, and Ozonides of Alkali and Alkaline Earth Metals, I. I. Volnov
- ↑ Chemistry - Science and Technology III
- ↑ Advanced Chemistry, Michael Clugston, Rosalind Flemming
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.