| Natria oksalato | |||
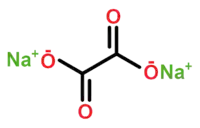 | |||
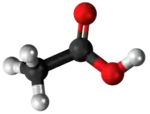
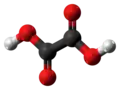
| Kemia strukturo de la Natria oksalato | |||
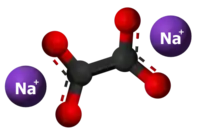 | |||
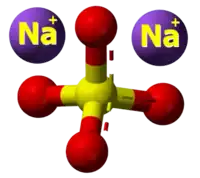
| 3D Kemia strukturo de la Natria oksalato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 62-76-0 | ||
| ChemSpider kodo | 5895 | ||
| PubChem-kodo | 6125 | ||
| Fizikaj proprecoj | |||
| Molmaso | 133.999 g mol−1 g mol−1 | ||
| Smiles | C(=O)(C(=O) [O-])[O-].[Na+].[Na+] | ||
| Denseco | 2.34 g/cm3 | ||
| Refrakta indico | 1,48 | ||
| Fandopunkto | 260 °C (500 ℉; 533 K) (malkomponiĝas) | ||
| Solvebleco | |||
| Solvebleco |
| ||
| Merck Index |
| ||
| Mortiga dozo (LD50) | 11160 mg/kg (muso, buŝa) | ||
| Sekurecaj Indikoj | |||
| Risko | R21 R22 R34 | ||
| Sekureco | S2 S24 S25 S26 S36/37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H302, H312, H302+312, H319 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P270, P280, P301+312, P302+352, P305+351+338, P312, P330, P337+313, P362+364, P501 | ||
(25 °C kaj 100 kPa) | |||
Natria oksalato, oksalato de natrio aŭ Na2C2O4 estas natria salo de oksalata acido, blanka substanco, senodora pulvoro, kiu malkomponiĝas je 250–270 °C. Natria oksalato povas agi kiel reduktagento, kaj uzatas kiel primara normo por normigo de solvaĵoj de kalia permanganato[2], indikita de la dana kemiisto S. P. L. Sørensen (1868-1939). Natria oksalato trovatas kiel natura erco en la mineralo natroksalato[3]. Ĝi estas rare trovata kaj limigita al la solaj natriaj kondiĉoj de la ultra-alkalaj pegmatitoj[4].
Biologiaj activecoj
Tiel kiel aliaj oksalatoj, natria oksalato estas toksa al homoj. Ĝi povas kaŭzi brulvundojn en la buŝo, gorĝo kaj stomako; sanga vomado, kapdoloro, muskolaj kramfoj kaj konvulsioj; falo en sangopremo, korfiasko, ŝoko, komo kaj ebla morto. Ingestado inter 10 kaj 15 gramoj per kilogramo estas konsiderata mortiga por homoj.
Samkiel citratoj, oksalatoj povas uzati por forigo de kalciaj jonoj (Ca2+) el la sangoplasmo. Ĝi ankaŭ malpermesas sangokoaguliĝon. Rimarku ke per forigo de kalciaj jonoj el la sango, natria oksalato povas difekti cerbofunkcion kaj plialtigi kalciajn deponejojn sur la renoj.
Sintezoj
Sintezo 1
- Preparado per traktado de oksalata acido kaj natria hidroksido:
|
|
Sintezo 2
- Preparado per traktado de "oksalata anhidrido" kaj natria hidroksido:
|
|
Sintezo 3
- Preparado per traktado de oksalata acido kaj natria karbonato:
|
|
Sintezo 4
- Preparado per traktado de natria klorido kaj etila oksalato:
|
2 |
Sintezo 5
- Preparado per interagado de alila oksalato kaj natria formiato:
|
|
Sintezo 6
- Preparado per acida interŝanĝo de oksalata acido kaj natria acetato:
|
|
Sintezo 7
- Preparado per baza interŝanĝo de izopropila oksalato kaj natria hidroksido:
|
|
Sintezo 8
- Preparado per termolizo de la natria formiato:
|
2 |
Reakcioj
Reakcio 1
- Hidrolizo de la natria oksalato
|
|
Reakcio 2
- Reakcio kun karbonata acido:
|
|
Reakcio 3
- Preparado de natria buterato per acida interŝanĝo inter natria oksalato kaj buterata acido:
|
|
Reakcio 4
- Preparado de alila oksalato per alkohola interŝanĝo de natria oksalato kaj alila alkoholo en acida medio:
|
|
Reakcio 5
- Reduktigo de la natria oksalato
|
|
Reakcio 6
- Reakcio kun kloramino
|
|
Reakcio 7
- Reakcio kun klorida acido:
|
|
Reakcio 8
Kiam hejtata, natria oksalato malkomponiĝas en natria karbonato kaj karbona unuoksido:
|
|
Reakcio 9
- Natria oksalato uzatas por normigado de solvaĵoj de kalia permanganato:
|
5 |
Youtube
Literaturo
- Chemical Book
- Santa Cruz Biotechnology
- ACS Publications
- A Manual for the Chemical Analysis of Metals
- Comparison of redox standards, Edição 24, K. M. Sappenfield, G. Marinenko, John Louis Hague, Institute for Basic Standards (U.S.)
- Linne & Ringsrud's Clinical Laboratory Science: The Basics and Routine ..., Mary Louise Turgeon
- Handbook of Flotation Reagents: Chemistry, Theory and Practice: Volume 2 ..., Srdjan M. Bulatovic
| ||||||
| ||||||
Referencoj
- ↑ LabChem
- ↑ Advanced Engineering Chemistry, Manas Senapati
- ↑ Webmineral
- ↑ Geology