| Natria naftalenido | |||
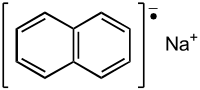 | |||
| Plata kemia strukturo de la Natria naftalenido | |||
 | |||
| Tridimensia strukturo de la Natria naftalenido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 3481-12-7 | ||
| ChemSpider kodo | 10004279 | ||
| PubChem-kodo | 11829632 | ||
| Fizikaj proprecoj | |||
| Molmaso | 151,155 g mol−1 | ||
| Smiles | [Na+].[c-]1cccc2ccccc12 | ||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H228, H410 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P240, P241, P273, P280, P370+378, P391, P501 | ||
(25 °C kaj 100 kPa) | |||
Natria naftalenido, naftalenido de natrio aŭ C10H8Na estas organika salo de natrio kaj naftaleno, preparata en laboratorio, kaj uzata kiel reduktanto en organikaj sintezoj kaj neorganika kemio. Ĝi ne estis izolita kiel solido, sed estas freŝe preparata antaŭ ol uzado.
Sintezo
- Natria naftaleno prepareblas per agitado de la metalo kun naftaleno en ĉeesto de solvanto, kiu ĝenerale estas kvarhidrofurano aŭ dumetoksetano:
Preparado
Alkalaj metalaj naftalenidoj preparatas per agitado de la metalo kun naftaleno en la ĉeesto de etera solvaĵo, ĝenerale kvarhidrofurano aŭ dumetoksetano, ankaŭ konata kiel glimo. La rezulta salo estas brunverda. La anjono estas forte alkala, kaj ordinara degradiga vojo rezultas e reakcio kun akvo kaj rilataj protohavaj fontoj. Ĉi reakcioj estigas duhidronaftalenon:[2]
Literaturo
- Chemical Book
- Molbase
- ChemCD
- ACS Publications
- Organometallic Chemistry: A review of the literature published during 1971, R. K. Harris
- Encyclopedia of Environmental Science and Engineering, Fifth Edition ..., James R. Pfafflin, Edward N. Ziegler
- Adhesion Science, John Comyn
- Organometallics in Synthesis, Third Manual, Manfred Schlosser
| ||||||
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.