| Natria dutionato | |||
 | |||
| Kemia strukturo de la Natria dutionato | |||
 | |||
| 3D Kemia strukturo de la Natria dutionato | |||
| Alternativa(j) nomo(j) | |||
| |||
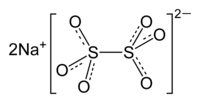
| Kemia formulo | |||
| CAS-numero-kodo |
| ||
| ChemSpider kodo | 128833 | ||
| PubChem-kodo | 146045 | ||
| Fizikaj proprecoj | |||
| Aspekto | Blanka kristala pulvoro | ||
| Molmaso |
| ||
| Denseco | 2,189 g/cm3 | ||
| Fandopunkto | |||
| Bolpunkto | 267 °C (513 ℉; 540 K) malkomponiĝas | ||
| Solvebleco|Akvo | |||
| Sekurecaj Indikoj | |||
| Risko[1] | R26 | ||
| Sekureco[1] | S36/37/38 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H251, H302 | ||
| GHS Deklaroj pri antaŭgardoj | P235+410, P264, P270, P280, P330, P301+312, P407, P413, P420, P501 | ||
(25 °C kaj 100 kPa) | |||
Natria dutionato, dutionato de natrio aŭ Na2S2O6 estas grava neorganika komponaĵo, natria salo de dutionata acido, kie la sulfuro havas oksidonombron +5. Ĉi-salo ne devas konfuziĝi kun alia konata kiel natria dutionito, kiu estas potenca reduktagento kaj tre uzata en analizoj kemiaj kaj biokemiaj.
Natria dutionato perdas kristaliĝan akvon kiam temperaturo atingas 110 °C. Kiam hejtata al 267 °C ĝi dissociiĝas en Na2SO4 kaj SO2. La tekstila industrio priskribas ke natria dutionato estas la plej efika komponaĵo por forigado feraj kaj manganaj makuloj el vestaĵoj, do, miksaĵo da likvo-sapo kaj natri dutionato estas rekomendata por lavado de malpuraĵoj.
Sintezoj kaj preparadoj
- Reakcio inter natria bisulfito kaj mangana duoksido:
- Oksido-redukta reakcio inter la natria tiosulfato, kloro kaj natria hidroksido:
- Reakcio inter dutionato de mangano kaj natria karbonato[2]:
- Reakcio inter dutionato de bario kaj natria bikarbonato:
- Reakcio inter dutionato de bario kaj natria sulfato:
Reakcioj
- Alkalo-metalaj dutionatoj malkomponiĝas sub alta temperaturo laŭ la ekvacio[1]:
Proprecoj
Natria dutionato estas tre stabila komponaĵo, kiu ne oksidiĝas per permanganato, dukromiato aŭ bromo. Ĝi povas oksidiĝi al sulfato pere de fortaj oksidigaj kondiĉoj, kiu inkluzivas longedaŭra bolado dum unu horo kun sulfata acido 5M kaj troo da kalia dukromiato, aŭ traktado kun troo da hidrogena peroksido bolanta sur koncentrita klorida acido.
La anjono S2O62− ne estas bona reduktiga grupo. Do, ĝi daŭre uzatas por estigado de ekskluzivaj kristaloj el grandaj katjonaj kompleksaĵoj en altaj oksido-statoj sen reduktigo de la metala komplekso.
Literaturo
- Chemical Book
- DrugFuture
- Environmental
- ChemNet
- GuideChem Arkivigite je 2015-09-24 per la retarkivo Wayback Machine
- Flavoprotein Protocols, Steven K. Chapman
- Delmar Nurse’s Drug Handbook 2012 Edition, George Spratto, Adrienne Woods
- Modern Methods for Analysing Archaeological and Historical Glass, Koen H. A. Janssens
| ||||||
Referencoj
- 1 2 3 Accorporation
- ↑ The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium ..., William A. Hart, O. F. Beumel, Thomas P. Whaley