| Natria orto-arsenito | ||||
 | ||||
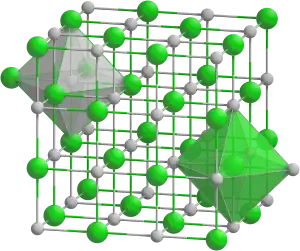
| Kemia strukturo de la Natria orto-arsenito | ||||
 | ||||
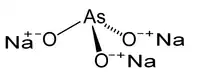
| 3D Kemia strukturo de la Natria orto-arsenito | ||||
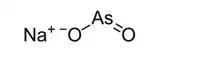 | ||||
| Kemia strukturo de la Natria meta-arsenito | ||||
 | ||||
| Kemia strukturo de la Kvarnatria piro-arsenito | ||||
 | ||||
| 3D Kemia strukturo de la Kvarnatria piro-arsenito | ||||
| Kemiaj formuloj | ||||
| CAS-numero-kodo | 7784-46-5 | |||
| PubChem-kodo | 443495 | |||
| Fizikaj proprecoj | ||||
| Aspekto | Blanka aŭ griza solido, tre higroskopa | |||
| Molmaso |
| |||
| Denseco | 1.87 g/cm3 | |||
| Fandopunkto | 550 °C (1,022 ℉; 823 K) malkomponiĝas | |||
| Solvebleco | Akvo:156 g/100 mL | |||
| Mortiga dozo (LD50) | 41 mg/kg (muso, buŝa) | |||
| Ekflama temperaturo | ne bruliva | |||
| Sekurecaj Indikoj | ||||
| Risko | R23 R25 R45 R50 R53 | |||
| Sekureco | S(S1/2) S20 S21 S28 S45 S60 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H300+310, H331, H350, H400, H410 | |||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P261, P264, P270, P271, P273, P281, P301+310, P304+340, P308+313, P311, P321, P330, P391, P403+233, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Natria arsenito, arsenito de natrio estas arsenita salo de natrio, kiu prezentiĝas sub tri formoj: meta-arsenito de natrio unubaza (NaAsO2), orto-arsenito de natrio tribaza Na3AsO3 kaj piro-arsenito de natrio kvarbaza (Na4As2O5)[1].
Sintezoj
Sintezo 1
- Meta-arsenito de natrio estiĝas pere de varma reakcio inter arseno kaj natria hidroksido:
|
|
Sintezo 2
- aŭ pere de arsena trioksido kaj natria hidroksido:
|
|
Sintezo 3
- aŭ pere de varme koncentrita solvaĵo de natria karbonato:
|
|
Reakcioj
Reakcio 1
- Kiam varmigita, natria arsenito malkomponiĝas suferante misproporcion:
|
|
Reakcio 2
- Varma akvo malkomponigas ĝin por estigi natrian duhidrogenan arseniton:
|
|
Reakcio 3
- Natria meta-arsenito iom-post-iom oksidiĝas de la atmosfera oksigeno al orto-arsenito:
|
|
Reakcio 4
- En alkalaj solvaĵoj la meta-arsenito oksidiĝas al hidrogena arsenato:
|
|
Reakcio 5
- Meta-arsenito reakcias kun diluitaj acidoj:
|
|
Reakcio 6
- La samo okazas kun koncentritaj acidoj:
|
|
Reakcio 7
- Natria meta-arsenito reakcias kun alkaloj por estigi orto-arsenitojn:
|
|
Reakcio 8
- Ĝi oksidiĝas en alkala medio:
|
|
Reakcio 9
- Natria meta-arsenito reakcias kun stana (II) klorido kaj klorida acido por estigi arsenon, heksaklorostanato de hidrogeno kaj natria klorido:
|
|
Reakcio 10
- Ĝi reakcias kun arĝenta nitrato estigante arĝentan meta-arseniton kaj natrian nitraton:
|
|
Reakcio 11
- Natria orto-arsenito reakcias kun hidrogena peroksido por estigi natrian arsenaton[2]:
|
|
Reakcio 12
- Natria arsenito reakcias kun kalia permanganato kaj sulfata acido[3]:
|
|
Reakcio 13
- Natria orto-arsenito reakcias kun jodo por estigi natrian arsenatoj kaj jodidan acidon:
|
|
Literaturo
- Sigma Aldrich
- Cameo Chemicals
- Compounds of Arsenic, Antimony, and Bismuth: First Supplement Covering the ..., Michael Dub
- United States Environmental Protection Agency Arkivigite je 2021-04-18 per la retarkivo Wayback Machine
- Pharmaceutical Drug Analysis, Ashutosh Kar
- Chemistry of Pesticides, N. N. Melnikov
- Chemistry of Arsenic, Antimony and Bismuth, N.C. Norman
| ||||||
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.