| Metila kloroformiato | |||||
 | |||||
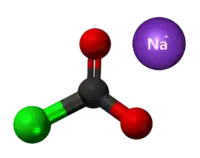
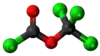
| Plata kemia strukturo de la Metila kloroformiato | |||||
 | |||||
| Tridimensia kemia strukturo de la Metila kloroformiato | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 79-22-1 | ||||
| ChemSpider kodo | 6337 | ||||
| PubChem-kodo | 6586 | ||||
| Merck Index | 15,6114 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora likvaĵo kun forta agrabla odoro | ||||
| Molmaso | 94.494 g·mol-1 | ||||
| Denseco | 1.223g cm−3 | ||||
| Fandpunkto | -61 °C[1] | ||||
| Bolpunkto | 71 °C | ||||
| Refrakta indico | 1,4267 | ||||
| Ekflama temperaturo | 4.5 °C | ||||
| Acideco (pKa) | 0.26 | ||||
| Solvebleco | Akvo:300 g/L | ||||
| Mortiga dozo (LD50) | 67 mg/kg (buŝe)[2] | ||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H225, H300, H302, H312, H314, H318, H330[3] | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P264, P270, P271, P280, P284, P301+310, P301+312, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P310, P312, P320, P321, P330, P363, P370+378, P403+233, P403+235, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Metila kloroformiato estas metila estero de la kloroformiata acido, senkolora likvaĵo kun forte agrabla odoro, solvebla en benzeno, kloroformo, etero kaj etanolo kaj malmulte solvebla en akvo. Metila kloroformiato uzatas kiel peranto en kemiaj sintezoj tiaj kiaj karbonatoj, karbamatoj, tinkturoj, farmaciaĵoj, herbicidoj kaj insekticidoj.
Metil-kloroformiato estas neakordigebla kun akvo, fortaj oksidigagentoj, alkoholoj kaj bazoj (inklude de aminoj). Ĝi malrapide malkomponiĝas en akvo por estigi metanolon, HCl kaj CO2. La reakcio plimultiĝas kiam temas pri varma akvo. Ĝi atakas multajn metalojn ĉefe en humida atmosfero. La substanco povas absorbiĝi de la homa korpo per inhalado de ĝiaj vaporoj, per haŭto kaj ingestado.
Sintezoj
Sintezo 1
- Preparado per agado de kloroformiata acido kaj metila alkoholo:
|
|
Sintezo 2
- Preparado per traktado de kloroformiata anhidrido kaj metila alkoholo:
|
|
Sintezo 3
- Preparado per reakcio de kloroformiata acido kaj metila klorido:
|
|
Sintezo 4
- Preparado per interagado de natria kloroformiato kaj metila klorido:
|
|
Sintezo 5
- Preparado per interagado de fenetila kloroformiato kaj metila formiato:
|
|
Sintezo 6
- Preparado per acida transesterigo inter kloroformiata acido kaj metila salikato:
|
|
Sintezo 7
- Preparado per alkohola transesterigo inter benzila kloroformiato kaj metila alkoholo:
|
|
Sintezo 8
- Preparado per agado de la kloro sur metila formiato:
|
|
Sintezo 9
- Preparado per agado de la fosgeno sur metila alkoholo:
|
|
Sintezo 10
- Preparado per agado de la formiata acido sur metila alkoholo:
|
|
Sintezo 11
- Preparado per hidroformiliigo de la karbona unuoksido sur metanolo sekvata per klorigo de la metila acetato:
|
|
Reakcioj
Reakcio 1
- Hidrolizo de la metila kloroformiato:
|
|
Reakcio 2
- Sapigo de la metila kloroformiato:
|
|
Reakcio 3
- Reakcio per acida transesterigo kun formiata acido:
|
|
Reakcio 4
- Reakcio per alkohola transesterigo kun etila alkoholo:
|
|
Reakcio 5
- Reduktigo de la metila kloroformiato:
|
|
Reakcio 6
- Reakcio kun NH3:
|
|
Reakcio 7
- Reakcio kun HCl:
|
|
Reakcio 8
- Siavice, metila kloroformiato reakcias kun kloro sub ultra-viola lumo por doni dufosgenon. Dufosgeno estas senkolora likvaĵo kaj grava reakcianto en la sintezo de organikaj komponaĵoj. Ĝi rilatas al fosgeno sed estas pli konvene manipulita ĉar ĝi estas likvaĵo, dum fosgeno estas gaso.
|
|
Literaturo
- Chemical Book
- Merck Millipore Arkivigite je 2017-09-05 per la retarkivo Wayback Machine
- Lotus Illustrated Dictionary of Organic Chemistry, Terry Hills
- Handbook of Analytical Derivatization Reactions, Daniel R. Knapp
- Phosgenations: A Handbook, Livius Cotarca, Heiner Eckert
- Reactive Intermediates in Organic Chemistry: Structure, Mechanism, and Reactions, Maya Shankar Singh