| Metanosulfinila klorido | |||
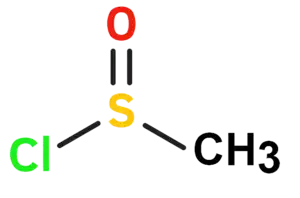 | |||
| Plata kemia strukturo de la Metanosulfinila klorido | |||
 | |||
| Tridimensia kemia strukturo de la Metanosulfinila klorido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 676-85-7 | ||
| ChemSpider kodo | 477297 | ||
| PubChem-kodo | 548463 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora likvaĵo | ||
| Molmaso | 98,544 g·mol−1 | ||
| Bolpunkto | 164,2 °C | ||
| Refrakta indico | 1,5038 | ||
| Ekflama temperaturo | 53,1 °C | ||
| Solvebleco | Akvo:Nesolvebla | ||
| Sekurecaj Indikoj | |||
| Riskoj | R23 R24 R25 | ||
| Sekureco | S26 S36/37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H226, H314 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P264, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P370+378, P403+235, P405, P501[1] | ||
(25 °C kaj 100 kPa) | |||
Metanosulfinila klorido aŭ CH3ClOS estas kemia kombinaĵo, apartenanta al la funkcia grupo de la esteroj de la kloro kaj dumetila dusulfido. Metanosulfinila klorido estas senkolora likvaĵo, uzata kiel analiza reakciaĵo en kemiaj sintezoj kaj en la fabrikado de kosmetikaĵoj kaj farmaciaĵoj. Kutime ĝi estiĝas per kondensiĝa reakcio aŭ per esterigo de Fischer-Speyer kun sulfata acido kiel katalizilo. Metanosulfinila klorido estas malmulte solvebla en akvo, sed tute solvebla en alkoholo, duetila etero, kloroformo kaj plejmulto el la organikaj solvantoj. Metanosulfinila klorido reakcias kun fortaj oksidigagentoj kaj fortaj bazoj kaj posedas antifungajn kaj antibakteriajn proprecojn.
Sintezoj
Sintezo 1
- Preparado per oksidado de la peracetata acido sur metanosulfenila klorido:
|
|
Sintezo 2
- Preparado per traktado de metanosulfinila acetato kaj HCl:
|
|
Sintezo 3
- Preparado per reakcio de tiometanolo kaj hipoklorita acido:
|
|
Sintezo 4
- Preparado per reakcio inter metilmagnezia klorido kaj tionila klorido:
|
|
Sintezo 5
- Preparado per klorigo de la dumetila dusulfido sekvata per oksidado kun acetata anhidrido:[2]
|
|
Reakcioj
Reakcio 1
- Hidrolizo de la metanosulfinila klorido:
|
|
Reakcio 2
- Reakcio kun arĝenta (I) hidroksido:
|
|
Reakcio 3
- Reakcio per acida transesterigo kun formiata acido:
|
|
Reakcio 4
- Reakcio kun natria hidroksido:
|
|
Literaturo
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.





-hydroxide-3D-balls-ionic.png.webp)


