| Metakrilonitrilo | ||||
 | ||||
| Plata kemia strukturo de la Metakrilonitrilo | ||||
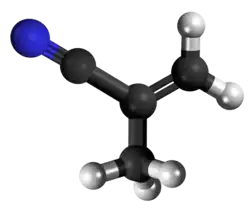 | ||||
| Tridimensia strukturo de la Metakrilonitrilo | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 126-98-7 | |||
| ChemSpider kodo | 29101 | |||
| PubChem-kodo | 31368 | |||
| Merck Index | 15,6014 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora travidebla ĝis iomete flaveca likvaĵo kun odoro je amaraj migdaloj. | |||
| Molmaso | 67.09 g·mol−1 | |||
| Denseco | 0.8 g cm−3 | |||
| Fandpunkto | -35.8 °C[1] | |||
| Bolpunkto | 90.3 °C | |||
| Refrakta indico | 1,582 | |||
| Ekflama temperaturo | 13 °C | |||
| Memsparka temperaturo | 464 °C | |||
| Solvebleco | Akvo:
| |||
| Mortiga dozo (LD50) | 120 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Risko | R11 R23/24/25 R43 | |||
| Sekureco | S9 S16 S18 S29 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[2] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Averto | |||
| GHS Deklaroj pri damaĝoj | H225, H301, H311, H317, H330, H331 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P272, P280, P284, P301+310, P302+352, P303+361+353, P304+340, P310, P311, P312, P320, P321, P330, P333+313, P361, P363, P370+378, P403+233, P403+235 | |||
(25 °C kaj 100 kPa) | ||||
Metakrilonitrilo estas kemia organika komponaĵo, nesaturita alifata nitrilo vaste uzata en la preparado de homopolimeroj, kunpolimeroj, elastomeroj kaj plastoj, kaj kiel kemia peranto en la preparado de acidoj, amidoj, aminoj kaj aliaj nitriloj.
Metakrilonitrilo ankaŭ uzatas kiel anstataŭanto de la akrilonitrilo en la manufakturo de akrilonitrilo-/butadieno-/stireno-simila polimero. Ĝi estas senkolora, bruligebla kaj toksa likvaĵo, kiu estas migdalodora. Kiam ekspoziciata al varmo, flamoj aŭ sparkaĵoj, ĝi estas eksplodema ellasante fumojn da nitriloj kaj nitrogenaj oksidoj.
| Izomerio - C4H5N | ||||
 | 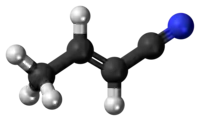 |  | 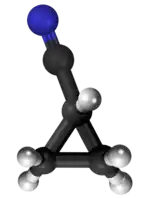 | |
Sintezo
- Metakrilonitrilo prepariĝas per senhidratigo de la acetono-cianhidrino:
 |
Literaturo
- NIST Chemistry WebBook
- Chemical Book
- Toxnet
- Principles of Polymer Chemistry, A. Ravve
- Polymer Science Dictionary, M. Alger
- Biological Reactive Intermediates III: Mechanisms of Action in Animal Models ..., James J. Kocsis, David J. Jollow, Charlotte M. Witmer, Judd O. Nelson, Robert R. Snyder
Vidu ankaŭ
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.




