| Luteolino | ||
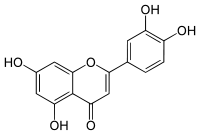 | ||
| Plata kemia strukturo de la Luteolino | ||
 | ||
| Tridimensia kemia strukturo de la Luteolino | ||
.jpg.webp) | ||
| Luteolino estas flaveca solidaĵo trovata en plantoj de la familio de la Reseda luteola. | ||
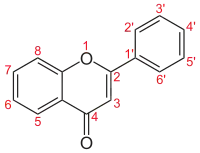 | ||
| Numerigo de la karbonaj strukturoj de la flavonoj. | ||
| Kemia formulo | ||
| CAS-numero-kodo | 491-70-3 | |
| ChemSpider kodo | 4444102 | |
| PubChem-kodo | 5280445 | |
| Merck Index | 15,5675 | |
| Fizikaj proprecoj | ||
| Aspekto | blanka aŭ flaveca solidaĵo | |
| Molmaso | 286,239 g·mol−1 | |
| Denseco | 1,2981g cm−3[1] | |
| Fandpunkto | 329,5 °C | |
| Bolpunkto | 616,1 °C[2] | |
| Refrakta indico | 1,768 | |
| Ekflama temperaturo | 239,5 °C[3] | |
| Acideco (pKa) | 6,5 | |
| Mortiga dozo (LD50) | 180 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Riskoj | R36/37/38 | |
| Sekureco | S26 S36 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P321, P332+313, P337+313, P362, P403+233, P405, P501[4] | |
(25 °C kaj 100 kPa) | ||
Luteolino, (3',4',5,7-kvarhidrokso-flavono) aŭ C15H10O6 estas flavonoidaj naturaj kunmetaĵoj, kristalflava solidaĵo, apartenanta al la familio de la "flavonoj", ĉeestanta en plantoj kaj vegetaloj inter ili la Reseda luteola, kiu estis uzata kiel fonto por la fabrikado de tinkturoj minimume ekde la unua miljaro antaŭ Kristo. Luteolino ankaŭ trovatas en la ŝmalco, senŝeligita maizoleo, brokoloj, kaj en arakido-semoj.
Proprecoj
Samkiel la apigenino, luteolino prezentas antiinflamajn kaj antioksidigajn proprecojn krom esti neŭroprotektiva. Eksperimentoj elmontras ke la luteolino agas, malpliigas aŭ detruas tumorigajn ĉelojn. Dietoj riĉaj je luteolino inhibas la proliferadon de tumoraj ĉeloj kaj la "angiogenezo", kiu estas la formado de novaj sangovazoj ekde la antaŭekzistantaj. Eksperimentoj elmontris ke la luteolino povas uziĝi en la traktado de la epilepsio.[5]
Oni konstatis ke luteolino estas pli potenca ol la karoteno aŭ la tokoferolo.[6] Prostata kancero estas la dua plej maltrankviliga kaŭzo je viraj kancerrilataj mortoj en la tuta mondo. Nuntempaj esploroj malkovris ke la luteolino signife inhibas la agadon de kancerĉeloj en viroj. Tamen la konado pri tiuj aktivecoj ankoraŭ ne estas bone komprenata.
Historio
Luteolino estis unue izolita sub pura formo en 1829 de la franca kemiisto Michel-Eugène Chevreul (1786-1889). La empiria formulo estis priskribita en 1864 de la aŭstraj kemiistoj Heinrich Hlasiwetz (1825-1875) kaj Leopold Pfaundler (1839-1920). En 1896, la angla kemiisto Arthur George Perkin (1861-1937), (dua filo de William Henry Perkin (1838-1907), kiu uzis la kininon por la traktado de la malario), proponis la korektan strukturon de la luteolino. La proponita strukturo de Perkin estis konfirmita en 1900 de la pola-svisa kemiisto Stanislaw Kostanecki (1860-1910) kaj liaj studentoj A. Różycki kaj J. Tambor sintezis luteolinon.[7]
Sintezoj
Sintezo 1
- Preparado ekde la apigenino per aldono de hidroksila grupo (OH) en la karbono de la 5-a pozicio de la fenila ringo:
|
|
Sintezo 2
- Preparado ekde la kverketino per forigo de hidroksila grupo (OH) en la karbono de la 3-a pozicio de la kromenonila ringo:
|
|
Sintezo 3
- Preparado ekde la naringenino per aldono de hidroksila grupo (OH) en la karbono de la 5-a pozicio de la fenila ringo kaj forigo de du hidrogenatomoj en la karbonoj de la pozicioj 2-a kaj 3-a de la kromenonila ringo:
|
|
Sintezo 4
- Preparado ekde la miriketino per forigo de du hidroksilaj grupoj (OH), unu en la karbono de la 3-a pozicio de la kromenonila ringo kaj alia en la karbono de la 3-a pozicio de la fenila ringo:
|
|
Reakcioj
Reakcio 1
- Konvertado al apigenino per forigo de hidroksila grupo (OH) en la karbono de la 5-a pozicio de la fenila ringo:
|
|
Reakcio 2
- Konvertado al kverketino per aldono de hidroksila grupo (OH) en la karbono de la 3-a pozicio de la kromenonila ringo:
|
|
Reakcio 3
- Konvertado al "naringenino" per forigo de hidroksila grupo (OH) en la karbono de la 5-a pozicio de la fenila ringo kaj aldono de du hidrogenatomoj en la karbonoj de la pozicioj 2-a kaj 3-a de la kromenonila ringo:
|
|
Reakcio 4
- Konvertado al miriketino per aldonoj de du hidroksilaj grupoj (OH), unu en la karbono de la 3-a pozicio de la kromenonila ringo kaj alia en la karbono de la 3-a pozicio de la fenila ringo:
|
|
Vidu ankaŭ
Literaturo
- Science Direct
- NCBI Resources
- Flavonoids of the Sunflower Family (Asteraceae)
- Chamomile: Medicinal, Biochemical, and Agricultural Aspects
- Chemical Constituents of Bryophytes
- Delirium, Dementia, Amnestic, Cognitive Disorders: Advances in Research and ...
- Annual Bibliography of Significant Advances in Dietary Supplement Research ...
- Flavonoid Metabolism