| Lupusa nefrito | |
|---|---|
| malsano | |
|
| |
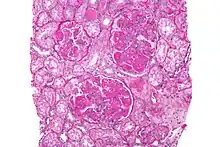
| Mikrofoto de difuza prolifera lupusa nefrito | |
| KIM-10 | N08.5 |
| Klinika bildo | |
| Kaŭzoj aŭ riskaj faktoroj |
lupuso |
| Trafita sistemo | renoj |
Lupusa nefrito (latine Lupus nephritis) estas la rena inflamo, kaŭzita de lupuso. Ĝi estas speco de glomerulonefrito, kiu estas ĉi-foje sekundara kaj havas certajn specifaĵojn.
Ofteco
Klinikaj manifestiĝoj de renaj problemoj aperas ĉe proksimume 50% de la lupusaj malsanuloj. La plej alta probableco estas ĉe afrikusonanoj (70%) kaj azianoj (82%)[1][2]. Komence de la malsano renaj damaĝoj estas ĉe 25-50% de la malsanuloj, poste ilin havas preskaŭ 60% de la plenkreskuloj kaj 80% de la infanoj[3]. Ĉe 15-20% de la pacientoj lupusa nefrito progresas ĝis la fina fazo de la rena malsufiĉo[4].
Mekanismo
Lupusa nefrito estas konsiderata paradigmo (modelo) de la imunokompleksa inflamo. Mekanismo de ĝia evoluo spegulas ĝeneralan patogenezon de lupuso. Kiel bazo de la malsano servas poliklona hiperaktiveco de B-ĉela sistemo, kiu manifestiĝas je nekontrolebla produktado de antikorpoj, kaj/aŭ difektoj de T-ĉela memreguligo, kaŭzanta misfunkcion de paraplegio de la ĉeloj kaj de la rekona procezo kun perdo de imuna toleremo al la propraj antigenoj, precipe al tiuj nukleaj. Al efektoraj mekanismoj de rena damaĝo apartenas: komplemento, polimorfaj ĉeloj, monocitoj, iliaj faktoroj de adhero kaj atraktoraj molekuloj, sintezo de citokinoj, kemokinoj, eikosanoidoj, endotelinoj ktp. Gravas ankaŭ damaĝoj de intersticio kaŭzitaj de CD8- kaj СD4+ T-ĉeloj kaj makrofagoj, kun posta estiĝo de fibrozo kaj perdo de peritubularaj kapilaroj[5].
Antikorpoj atakas nukleajn acidojn kaj proteinojn rilatajn al ĉela transskribado kaj mekanismo de translacioen: iliaj ĉefaj celoj estas nukleosomoj (DNA-histonoj) aŭ kvaropo de antigenoj el propra kromatino, etaj nukleaj ribonukleoproteinoj (sn RNP) kaj etaj citoplasmaj ribonukleoproteinoj (sc RNP). La plej gravaj por diagnozo estas la antikorpoj direktitaj kontraŭ la duspirala DNA, Smith (Sm)-antigeno kaj С1q. La plej specifaj kaj damaĝaj estas la antigenoj je la duspirala DNA. Potenciale damaĝaj por la renoj estas antikorpoj je DNA de izotipo IgG2b, kiuj lanĉas klasikan vojon de la aktivigo de komplemento[6].
Gravas ankaŭ kelkaj aliaj antikorpoj. Antikorpoj je Ro- kaj C1q+ asociiĝas kun gravaj renaj damaĝoj. Speciale grave la pason de la lupusa nefrito kaj ĝian prognozon influas antifosfolipidaj antikorpoj (AFA), ligitaj al evoluo de la antifosfolipida sindromo. AFA estas heterogena populacio de antikorpoj al antigenaj determinantoj de negative ŝarĝitaj (anjonaj) fosfolipidoj kaj/aŭ fosfolipidoligantaj (kofaktoraj) proteinoj de sangoplasmo. Al AFA apartenas: antikorpoj kaŭzantaj false poztivan Wassermann-ekzamenon, antikorpoj reagantaj kun kardiolipino kaj aliaj fosfolipidoj, kaj lupusa antikoagulanto (antikorpoj, kiuj longigas in vitro koaguliĝon de la sango en fosfolipide dependaj koagulaciaj testoj). En interagado de AFA kaj la fosfolipidoj la ĉefan rolon ludas mutacioj de proteinoj-kofaktoroj: β2-glikoproteino 1 (β2-GP 1), protrombino, koagulfaktoroj Х kaj ХIII, proteinoj C kaj S, metiltetrahidrafolatreduktazo kaj aliaj[6].
Polimorfismo de prokoagulaj proteinoj kaj de naturaj antikoagulantoj povas kaŭzi makro- kaj mikroangiopatiojn kaj ŝanĝi klinikan kaj morfologian bildojn de nefropatio. Specifa trajto de morfologio de lupusa nefrito estas granda polimorfismo inter kaj ene de la glomeruloj. Okazas proliferado de la glomeruloj, larĝiĝo kaj eniĝo de mesangiumo, membranaj ŝanĝoj, damaĝoj de kanaletoj kaj de intersticio. Specifaj, kvankam ne patognomoniaj, morfologiaj signoj de lupusa nefrito estas fibrinoida nekrozo de kapilaraj sinuoj, nuklea patologio (karioreksizoen kaj kariopiknozo), drasta loka dikiĝo de bazaj membranoj de kapilaroj de glomeruloj forme de "drataj sinuoj". Grava elemento de la damaĝoj estas angia trombozo (fibrinaj kaj hialinaj tromboj ene de kapilaroj), foje kombinata kun ĉeesto de AFA aŭ imunaj kompleksoj, enhavantaj krioglobulinojn. Dum imunohistokemia ekzameno oni trovas imunoglobulinojn G (ĉefe IgG1 kaj IgG3), tamen foje dominas IgA aŭ IgM[6].
Malsame ol la Bright-nefrito, lupusa nefrito havas specifajn manifestiĝojn kaj pli evidentajn bazajn nefrologiajn sindromojn.
Diagnozado
Lupusa nefrito estas la ĉefa mortokaŭzo ĉe la lupuso, pro kio ĝia frua diagnozado kaj ĝusta kuracado estas ege gravaj; pli malfrua kuracado estas pli komplika kaj kosta. Plej ofte lupusa nefrito aperas ĉe pacientoj, kiuj malsaniĝis en infanaĝo aŭ adolesko. Frua diagnozado ofte estas malfacila, ofte la solaj signoj estas proteinurio kaj ŝanĝo de urinaj sedimentaĵoj. Rena biopsio ebligas diagnozi aktivan lupuson de la klasoj III-V nur ĉe 25% de la pacientoj, kiuj ne havis tiujn ŝanĝojn[7].
Gravan rolon en la diagnozado ludas specifaj imunologiaj testoj: lupusan nefriton povas sugesti malaltigo de la nivelo de komponantoj de la komplemento C3 kaj C4, altiĝo de nombro de antikorpoj al la duspirala DNA kaj al С1q[8][9][10]. Rena biopsio helpas kompreni karakteron de la renaj damaĝoj, ilian klason, aktivecon, haveblon de morfologiaj signoj de nefrosklerozo kaj antaŭsignoj de ilia progreso, kaj helpas eltrovi tromban mikroangiopation kaj lupusan opodocitopation, kiuj renkontiĝas respektive ĉe 24% kaj 1,3% de la lupusaj malsanuloj[11][12][13][8].
Lupusa nefrito povas esti diagnozita surbaze de jenaj kriterioj, ellaboritaj de la Usona Kolegio de Reŭmatologio[14]:
- persista proteinurio > 0,5 gramoj/tage;
- kaj/aŭ 5 eritrocitoj, 5 leŭkocitoj aŭ cilindroj ĉe manko de infekto de urinaj vojoj;
- aldone: datumoj de rena biopsio konfirmantaj imunokompleksan nefriton.
Rena biopsio, kaze de manko de kontraŭindikiloj, devas okazi al ĉiuj pacientoj kun aktiva nefrito. Rezultoj de biopsio estas taksataj surbaze de jena klasifiko de la Internacia Asocio de Nefrologoj kaj Nefropatologoj (2003):
| Klaso (laŭ ISN/RPS) | Morfologiaj specifaĵoj | Klinikaj manifestiĝoj |
| I. Minimumaj ŝanĝoj de mesangiumo | Normalaj glomeruloj ĉe luma mikroskopio, deponaĵoj de imunaj kompleksoj ĉe imunofluoreska aŭ elektrona-mikroskopia esploro | Mankas ŝanĝoj je urino, renoj funkcias normale. Prognozo estas bona. Eblas transformiĝo je pli akuta tipo de lupusa nefrito. |
| II. Mesangiuma-proliferada lupusa nefrito | Larĝigo de mesangiumo, proliferado de mesangiumaj ĉeloj, subepitelia aŭ subendotelia deponaĵo de malgranda kvanto de imunaj kompleksoj. | Proteinurio <1 gramoj diurne, hematurio. Renaj funkcioj ekzistas. Nefrota sindromo kaj rena malsufiĉo kutime ne aperas. Prognozo estas bona se ne okazos transformiĝo je pli akuta morfologia tipo de lupusa nefrito. |
| III. Loka lupusa nefrito (< 50% damaĝitaj glomeruloj) III A — aktivaj damaĝoj | Aktiva aŭ kronika, segmenta aŭ totala, endo- aŭ eksterkapilara damaĝo engaĝinta <50% de la glomeruloj. | Proteinurio >1 gramo diurne, je 20-30% de la kazoj aperas nefrota sindromo. Moderaj ŝanĝoj de la karaktero de la urina sedimentaĵo. Okazas senhalta progreso de la malsano. Alta risko de estiĝo de kronika rena malsufiĉo. Prognozo estas relative bona kaze de adekvata terapio. |
| IV. Difuza lupusa nefrito
Difuza-segmenta (IV-S) aŭ ĝenerala (IV-G)
IV A — aktivaj damaĝoj | Morfologio estas la sama kiel ĉe la klaso III, sed engaĝitaj estas ≥50% de la glomeruloj. | Distingebla proteinurio, hematurio, cilindrurio, malalta nivelo de komponantoj de la komplemento. Ofte estiĝas arteria hipertensio kaj kronika rena malsufiĉo, rezistemo al la imunosubprema terapio. Prognozo kaze de neadekvata terapio estas malbona. |
| V. Membrana lupusa nefrito | Egala dikiĝo de baza membrano de la glomeruloj pro subepitelia kaj enmembrana deponadoj de imunaj deponaĵoj. | Proteinurio >3 gramoj diurne, nefrota sindromo kun aktiva urina sedimentaĵo. Rena malsufiĉo kaj arteria hipertensio estas relative maloftaj, imunologiaj perturboj manifestiĝas modere. Prognozo estas bona por la malsanuloj kun ne forta proteinurio, pli malbona kaze de nefrota sindromo. Ĉe parto de la pacientoj eblas spontanea remito. |
| VI. Progresanta nefrosklerozo | Difuza kaj segmenta glomerulosklerozo, atrofio de kanaletoj, intersticia fibrozo, arteriolosklerozo. | Klinikaj kaj laboratoriaj signoj de kronika rena malsufiĉo de diversaj niveloj. Progresado de la rena malsufiĉo ofte estas akompanata de malkresko de eksterrenaj manifestiĝoj de lupuso kaj de laboratoriaj signoj de ĝia aktiveco. Prognozo estas malbona. |
Nefrologiaj sindromoj

Ekzistas certaj specifaĵoj de la ĉefaj nefrologiaj sindromoj ĉe lupusa nefrito[15]:
Proteinurio estas absoluta signo de lupusa nefrito. Ĝi malofte atingas altajn indicojn kiel ĉe Bright-nefrito.
Nefrota sindromo kaze de lupusa nefrito havas malpli altan prognozan signifon ol ĉe Bright-nefrito. 10-jara postvivado ĉe ambaŭ kazoj estas simila krom se la malsano komenciĝis jam kun nefrota sindromo. Hipovolemio aperas malofte. Ofte samtempe okazas hipertonio kaj hematurio, kio atestas ofte haveblan samtempe akutan nefrotan sindromon, pro kio nefrota sindromo manifestiĝas malpli forte kaj hipovolemiaj krizoj okazas malofte. Recidivoj okazas malpli ofte ol ĉe Bright-nefrito.
Hematurio estas grava kriterio de aktiveco de lupusa nefrito. En 2-5% observeblas makrohematurio.
Leŭkociturio estas asepsa, kun dominanta limfociturio.
Rena malsufiĉo grave dependas de rapideco de kresko de sera kreatinino. Duobla kresko je malpli ol tri monatoj estas kriterio de rapida progreso. Rena malsufiĉo aperas ĉe 5-10% de la kazoj. Malsame ol ĉe Bright-nefrito, ĉe lupusaj malsanuloj en etapo de kronika rena malsufiĉo ofte observeblas alta aktiveco de la malsano, do lupusa nefrito postvivas eĉ klinikajn manifestiĝojn de uremio kaj aliaj simptomoj de sklerozo de rena histo, do multaj malsanuloj, trapasantaj kronikan sangodializon, devas ricevi ankaŭ imunosubpreman terapion.
Arteria hipertensio observeblas ĉe 60-70% de la malsanuloj. Ĝia ofteco kaj stato de sangodinamiko estas proksime ligitaj al grado de aktiveco de lupusa nefrito. Lupuso damaĝas la samajn organojn kiel arteria hipertensio — la renojn, koron, cerbon, sangovaskulojn. Arteria hipertensio malaltigas ĝeneralan kaj renan postvivadojn, altigas riskon de pereo de malsanuloj pro kora-sangovaskulaj komplikaĵoj. Se paciento kun lupusa nefrito atingis remiton, arteria hipertensio povas malaltiĝi, kio ankaŭ montras ligon inter la du malsanoj. Nefrosklerozo influas la arterian hipertension nur se la nefrosklerozaj ŝanĝoj estas gravaj. Risko de estiĝo de steroida arteria hipertensio ĉe malsanuloj kun lupuso estas 8-10%, kaze de renaj damaĝoj — ĝis 20%. Ĝian aperon influas ne nur dozo, sed ankaŭ longeco de glukokortikoida terapio. Se la procezo estas je meznivela aktiveco, ofte kialo de arteria hipertensio estas antifosfolipida sindromo[16].
Depende de akuteco de klinika situacio, paso kaj prognozo, oni klasifikas lupusan nefriton je aktiva kaj neaktiva. Neaktiva lupusa nefrito okazas kun eta urina sindromo aŭ malalta proteinurio[16].
Aktiva lupusa nefrito:
- rapide progresanta;
- malrapide progresanta:
- kun nefrota sindromo;
- kun distingebla urina sindromo.
Sangovaskulaj damaĝoj povas esti kaŭzitaj de lupusa nefrito mem aŭ de akompana antifosfolipida sindromo. Foje frue aperas aterosklerozo, inkluzive kun damaĝo de renaj sangovaskuloj. Plej ofte temas pri vaskulitoj kaj vaskulopatioj. Kaze de antifosfolipida sindromo estiĝas nefropatio forme de makroangiopatio, kiam estas trafataj grandaj sangovaskuloj (vejnaj kaj arteriaj trombozoj, stenozo aŭ okluzio de renaj arterioj kun estiĝo de renovaskula hipertensio kaj/aŭ de akuta rena malsufiĉo) aŭ forme de tromba mikroangiopatio de renaj sangovaskuloj kun estiĝo de iskemia nefropatio. Aterosklerozo kaj arteriolosklerozo kaŭzas aperon de rena iskemio. En tiaj kazoj oni faras renan biopsion por karakterizi morfologiajn ŝanĝojn, fari prognozon kaj elekti konvenan terapion[16].
Terapio
La ĉefa celo de la terapio de lupusa nefrito estas bremsi progresadon de la kronika rena malsano kaj preventi la finan renan malsufiĉon. Por tio estas uzataj strategioj de la indukta kaj subtena terapioj, kadre de kiuj estas uzataj glukokortiroidoj, Cyclophosphamide, Mycophenolate mofetil kaj, se ili ne efikas, rituksimabo[17]. La kuracado per imunosubpremiloj komenciĝas de indukta terapio kiu daŭras 3–6, foje ĝis 12 monatojn, kaj celas atingon de remito, post kio oni transiras al subtena terapio[18].
Ĝeneralaj informoj

Ju pli aktiva estas la procezo kaj ju pli akutaj estas morfologiaj signoj de la malsano, des pli frue necesas komenci aktivan terapion. Akompana arteria hipertensio ne estas konsiderata kontraŭindiko, ĉar plej ofte ĝi spegulas aktivecon de la procezo kaj malaperas post atingo de remito. Kadre de indukta terapio oni uzas glukokortiroidojn kaj kemioterapiajn agentojn. Plej ofte oni kombinas perbuŝan prenon de glukokortiroidoj kaj pulso-terapion, kio altigas efikecon kaj malaltigas riskon de komplikaĵoj. Uzado de kemioterapiaj agentoj kadre de indukta kaj subtena terapioj de lupusa nefrito estas nepra. Kaze de akuta procezo inter kemioterapiaj agentoj preferindas Cyclophosphamide laŭ interrompa skemo en altegaj dozoj (pulso-terapio). Post atingi remiton oni transiras al subtena terapio, uzante Azathioprine aŭ elektemajn kuracilojn surbaze de mikofenola acido. Eĉ kaze de kompleta remito, necesas longa subtena terapio, ofte kelkjara, plej ofte dumviva: por virinoj — 5 mg, por viroj — 7,5 mg[19]. Remito estas konsiderata proteinurio ≤0,2 gramoj diurne kune kun normalaj indicoj de malrapidiĝo de glomerula filtrado[20].
Klinikaj testoj, komparantaj efikecon de ĝeneralaj (Cyclophosphamide, Azathioprine) kaj elektemaj (Mycophenolate mofetil) kemioterapiaj agentoj ankoraŭ ne montris konvinke avantaĝojn de la elektemaj[19].
Daŭras testado de novaj elektemaj kuraciloj. Novaj strategioj de imuna terapio proponas totalan radiadon de limfoida sistemo aŭ de mjelo kun posta transplantado de praĉeloj. Jam ekzistas grupoj de anticitokinaj kuraciloj (аntiTNFα, аnti-interleukin 1-receptor: anakinra, аnti-interleukin 10, аnti-interleukin 6-receptor, аnti-interferon α, аnti B-lymphocyte stimulator (Blys)], kaj monoklonaj antikorpoj (аnti-CD20: rituksimabo, аnti-CD22: epratuzumab) kaj molekulaj blokiloj, kiuj rompas specifajn ĉenerojn de imuna rekono. Aperis unuaj provoj de eksperimenta kaj klinika aplikado de elektemaj kuraciloj kiel: LJP394 kiu elekteme influas sintezon de antikorpoj al duspirala DNA fare de B-limfocitoj, inhibanto de C5-komponanto de la komplemento ("Alexion"), prostaglandino 1, antagonistoj de receptoroj de tromboksano, T-ĉela vakcinado kaj aliaj[19].
Kaze de antifosfolipida sindromo necesas uzi antikoagulantojn kaj antiagregantojn ne nur dum akutiĝo, sed foje dumvive. Kaze de fina rena malsufiĉo oni aplikas sangodializon aŭ renan transplantadon. Malsame ol kaze de komenca glomerulonefrito, kaze de ekstrema lupusa nefrito povas konserviĝi alta aktiveco de lupusa procezo, kion atestas pluraj eksterrenaj simptomoj. Do malgraŭ nefrosklerozo necesas daŭrigi imunosubpreman terapion eĉ dum sangodializo. Rena transplantado estas plenumata nur kaze de malapero de signoj de lupusa aktiveco[19].
Kuracado de lupusa nefrito devas okazi laŭe al ĝia klasifika tipo. Ĉe la klasoj I kaj II oni ne preskribas imunosubpreman kaj glukokortiroidan terapiojn. Kaze de proteinurio ≥ 0,5 gramoj diurne kaj eritrociturio, devas esti preskribataj glukokortiroidoj kaj Azathioprine. Kaze de la klaso III (subendoteliaj deponaĵoj kaj proliferadaj ŝanĝoj de < 50% de la glomeruloj) necesas agresa terapio per glukokortiroidoj kaj imunosubpremiloj. La klaso V (subendoteliaj deponaĵoj kaj dikiĝo de membranoj de glomerulaj kapilaroj) akompane de la klasoj III/IV, postulas terapion saman kiel por la klasoj III kaj IV. Alie estas rigardata la "pure membrana V klaso". La klaso VI kun sklerozo de pli ol 90% de la glomeruloj, postulas ne imunosubpreman terapion, sed preparadon al rena transplantado. Klasifikaj subsekcioj A kaj C indikas gradon de kronikeco kaj aktiveco de la malsano. Se histopatologiaj ŝanĝoj estas kronikaj, probableco de respondo al la imunosubpremado estas malalta[14].
Post diagnozado de la aktiva lupusa nefrito krom la ĉefa terapio per glukokortiroidoj kaj kemioterapiaj agentoj devas esti preskribata aldona terapio:
- Aminokinolinaj kuraciloj (hidroksiklorokino) estas preskribataj en dozoj 200 ĝis 400 mg tage, se mankas kontraŭindikiloj;
- Kaze de proteinurio > 0,5 gramoj diurne estas preskribataj blokiloj de angiotensiaj receptoroj;
- Kaze de kresko de nivelo de lipoproteidoj de malalta denseco en sero ≥ 100 mg/dekalitro rekomendindas preskribo de statinoj.
Esploro montris ke uzado de hidroksiklorokino malaltigas indekson de damaĝoj, inkluzive renajn damaĝojn, kaj riskon de hiperkoaguliĝo kun evoluo de trombozoj. Blokiloj de angiotensiaj receptoroj malaltigas proteinurion je 30%, grave malaltigas riskon de duobliĝo de kreatinino kaj evoluon de nerenversebla rena malsufiĉo ĉe malsanuloj kun nediabeta nefropatio. Efikeco de angiotension-konvertaj fermentoj kaj blokiloj de receptoroj superas efikecon de blokiloj de kalciaj kanaloj[14].
Rekomendoj pri indukta terapio de lupusa nefrito de la klaso III-IV[14]:
- Por subpremi aktivecon de lupusa nefrito nepraj komponantoj de la terapio estas Cyclophosphamide kaj Mycophenolate mofetil. La imunosubprema terapio estas preskribata kombine kun tritaga pulso-terapio per 6-metilprednisolono (po 1000 tage) kaj posta preskribo de glukokortiroidoj forme de piloloj po 0,5-1,0 mg/kg tage, kun malaltigo de la dozo post atingo de necesa efiko;
- Mycophenolate mofetil estas preskribata po 2-3 gramoj tage dum la tuta periodo de la indukta terapio (ses monatoj);
- Cyclophosphamide rekomendidas uzi en unu el du reĝimoj:
- "Malaltaj dozoj" (EUROLUPUS) — po 500 mg envejne unufoje en du semajnoj, sume ses dozoj, kun posta preskribo de Azathioprine aŭ Mycophenolate mofetil forme de piloloj;
- "Altaj dozoj" (NIH-reĝimo, ellaborita de National Institute of Health, do NIH, Usono) — Cyclophosphamide envejne po 500-1000 mg/m² de la korpa surfaco + 6-metilprednisolono po 1000 ĉiumonate dum ses monatoj, poste Mycophenolate mofetil aŭ Azathioprine forme de piloloj;
- Oni povas konsideri Mycophenolate mofetil kaj Cyclophosphamide ekvivalentaj komponantoj de la indukta terapio. Longdaŭraj esploroj malmultas, sed ili montras efikecon de ĉiutaga dozo je 3 mg de Mycophenolate mofetil dum ses monatoj kun posta preskribo de malpli altaj dozoj dum tri jaroj.
- Elekto de dozo de Mycophenolate mofetil dependas de klinika-morfologia situacio. Ekzemple ĉe la klaso III sen duonlunoj aŭ se haveblas proteinurio kaj nivelo de kreatinino estas stabila (se mankas datumoj de la rena biopsio) akcepteblas dozo je 2-3 gramoj tage. Ĉe la klaso III-IV kun duonlunoj, kaj ĉe malsanuloj kun proteinurio kaj altiĝo de nivelo de kreatinino en lastaj 1-3 monatoj dozo povas esti 3 gramoj tage. Oni povas anstataŭigi Mycophenolate mofetil per mikofenola acido aŭ dissolvebla en intestoj natria mikofenolato, speciale kaze de naŭzo kaj vomo;
- Esploroj de la Nacia Instituto pri Sano konfirmis altan efikecon de "altaj dozoj" de Mycophenolate mofetil, ricevataj ĉiumonate dum ses monatoj kaj poste unufoje en tri monatoj dum du jaroj. Tio pli efike preventas akutiĝon de lupusa nefrito ol mallonga sesmonata kuracado. Tamen relative mallongaj kursoj de Cyclophosphamide (3-6 monatoj) kun posta preskribo de Azathioprine aŭ Mycophenolate mofetil, ankaŭ donas bonajn rezultojn.
Rekomendindas en plejparto de la kazoj komenci la induktan terapion per Cyclophosphamide aŭ Mycophenolate mofetil kaj ne modifi ĝin grave dum ses monatoj krom ŝanĝo de ĉiutaga dozo de glukokortiroidoj. Korekti terapion eblas post tri monatoj ekde ĝia komenco, se haveblas fidindaj pruvoj de malboniĝo de sanstato: proteinurio kreskis je 50% aŭ altiĝis kreatinino de sero[14].
Se paciento estas virino, kiu planas gravediĝon, oni rekomendas preskribi Mycophenolate mofetil por la indukta terapio, ĉar altaj dozoj de Cyclophosphamide povas kaŭzi nerenverseblan nefekundecon[14].
Rekomendoj pri la indukta terapio ĉe malsanuloj kun la klasoj IV aŭ IV/V de lupusa nefrito kun haveblo de duonlunoj. Oni rekomendas en tiaj kazoj fari la induktan terapion kun uzado de Cyclophosphamide aŭ Mycophenolate mofetil kaj komenci pulso-terapion per 6-metilprednisolono kaj preskribi glukokortiroidojn en piloloj en dozoj ne malpli ol 1 mg/kg tage. Ĉeesto de duonlunoj estas signo de malbona vivprognozo eĉ kaze de ĝustatempa intensa indukta terapio. Preskribo de Mycophenolate mofetil en dozo 2 mg tage estas ne malpli efika ol infuzioj de altaj dozoj de Cyclophosphamide[14].
Rekomendoj pri la indukta terapio ĉe malsanuloj kun la klaso V "membrana" de lupusa nefrito. Se konfirmiĝis tiu ĉi klaso kun masiva "nefrota" proteinurio, rekomendindas preskribi prednisolonon (0,5 mg/kg tage) kombine kun Mycophenolate mofetil po 2-3 gramoj tage dum 6 monatoj. Kiel alternativo povas servi Cyclophosphamide, ciklosporino, takrolimuso. Se nefrota sindromo mankas, oni povas sukcese uzi ciklosporinon kaj Azathioprine[21].
Rekomendoj pri la subtena terapio ĉe malsanuloj je lupusa nefrito de la klasoj III–V, kies stato pliboniĝis post la indukta terapio. Post atingi efikon, konfirmatan de la malsanulo mem kaj de laboratoriaj ekzamenoj, danke al la indukta terapio, rekomendindas por subteni ĝiajn rezultojn kaj plibonigi longdaŭran prognozon, preskribi Mycophenolate mofetil po 2 gramoj tage aŭ Azathioprine po 2 mg/kg tage dum almenaŭ 3 jaroj kune kun malaltaj dozoj de prednisolono (5-7 aŭ 5-10 mg diurne), eblas ankaŭ uzado de ciklosporino[21].
Rekomendoj por malsanuloj, ne respondintaj al la indukta terapio.
20-30% de la pacientoj estas rezistemaj al la indukta terapio[21].
Refrakta nefrito estas diagnozata se haveblas almenaŭ unu el jenaj kondiĉoj[21]:
- manko de malaltiĝo de diurna proteinurio kaj malboniĝo de malrapidiĝo de glomerula filtrado je la 4-a monato de la terapio;
- manko de parta respondo al la terapio je la 12-a monato;
- manko de plena respondo al la terapio je la 24-a monato.
En tiaj kazoj oni kombinas envejnajn infuziojn de Cyclophosphamide — inkluzive altegajn dozojn je 0,75–1 gramoj/m² unufoje monate dum 6 monatoj, poste unufoje je 3 monatoj dum 2-3 jaroj (NIH-reĝimo) aŭ Mycophenolate mofetil po 2-3 gramoj diurne, envejnajn infuziojn de rituksimabo po 500-1000 mg unufoje je 1-2 semajnoj, maksimume po 2000 mg unufoje je 6 monatoj, de homa envejna imunoglobulino (HEIG) po 0,5–1,0–2,0 gramoj/kg, plasmaferezon, imunoadsorbon, ciklosporinon forme de monoterapio aŭ kun aliaj kuraciloj[21]. Iuj rekomendas ankaŭ belimumabon[22].

HEIG ne estas preferata kuracilo por la pacientoj kun lupuso, krom se temas ankaŭ pri Kawasaki-malsano kaj dermatomiozito ĉe plenkreskuloj. Oni uzas ĝin se aperas imunodeficito, infektaj komplikaĵoj, kaj se glukokortiroidoj kaj imunosubpremiloj evidentiĝis neefikaj, speciale se temas pri personoj kun aŭtoimunaj citopenioj, damaĝaoj de la centra nerva sistemo, vaskulito kaj lupusa nefrito. Kaze de reŭmataj malsanoj ne ekzistas normigita skemo de enigado de la kuracilo, kutime estas uzataj dozoj po 0,4-2 gramoj/kg monate: po 1 gramo/kg dum 2 tagoj aŭ po 0,4 gramoj/kg dum 5 tagoj. La kursoj estas ripetataj ĉiumonate, ĉar la duonviva periodo de imunoglobulino estas 4 ĝis 6 semajnoj. Elektante la kuracilon necesas atenti enhavon de IgG (devas esti ne malpli ol 95%) kaj IgА (devas esti minimuma). Antaŭ ol preskribi HEIG necesas mezuri koncentriĝon de IgА en la sero de la paciento, kiu devas esti sufiĉe alta por eviti anafilaksion. En tre maloftaj kazoj observeblas akuta rena malsufiĉo. Ĝis 90 de la renaj perturboj asociitaj kun HEIG estas kaŭzitaj de aplikado de kuraciloj enhavantaj saĥarozon[23][24].
La ĉefa indico, kaŭzanta preskribon de plasmaferezo al la pacientoj kun lupuso, estas rapide progresanta lupusa nefrito rezistema al la kutima terapio per glukokortiroidoj kaj imunosubpremiloj, asociita kun krioglobulino kaj estiĝo de hiperkoaguliĝo. Plej ofte oni preskribas 3 ĝis 5 seancojn de plasmaferezo, forigante 1500-2500 da sangoplasmo, kun intervaloj inter ili po 2-3 tagoj; foje la plasmaferezo daŭras 3 semajnojn. Por preventi resalto-efikonen kaj altigi efikecon de la terapio, post ĉiu seanco oni enigas po 5 mg/kg da metilprednisolono. Fari plasmaferezon post la infuzioj de HEIG kaj rituksimabo ne havas sencon, ĉar plejparto de tiuj ĉi kuraciloj estos forigitaj. Plasmaferezo estas kontraŭindikita por la pacientoj kun forta hipoproteinemio (<50 gramoj/litro)[25].
Rituksimabo subpremas antikorpojn, induktas ĉelan paraplegion, subpremas aktivecon de B-limfocitoj[26]. Ramos-Casals M., Soto M.J., Cuardrado M.J. kaj Khamashta M.A. konkludis en 2009, ke ĉe 91% de la pacientoj, kiuj ne respondis al kutima terapio, sed ricevis rituksimabon, pliboniĝis indicoj, inkluzive la hematologiajn, kio klarigeblas per subpremado de sintezo de antieritrocitaj kaj antitrombocitaj aŭtoantikorpoj[27]. Tamen dum longa tempo ĝia aplikado por kuracado de lupuso ne havis oficialan aprobon[22].
La unua gena-inĝeniera biologia kuracilo (GIBK), speciale kreita kaj registrita por kuracado de lupuso, iĝis belimumabo — komplete homaj rekombinitaj monoklonaj antikorpoj, kapablaj preventi interagon de disslovebla formo de B-limfocita stimulilo (pBLyS) kun ĉelaj receptoroj de aŭtoreakciaj kaj "naivaj" B-limfocitoj, kion akompanas subpremado de sintezo de antikorpoj[28][29]. Krome blokado de BLyS povas malaltigi postvivecon de B-ĉeloj en ĝermocentroj de limfaj organoj, diferencigon de B-limfocitoj je aŭtoantikorpoproduktantaj ĉeloj, kaj sintezon de kontraŭinflamaj citokinoj (interleŭkinoj 21, 17 ktp), kiuj ludas gravan rolon en patogenezo de lupuso[30]. Uzado de belimumabo montris malakutiĝon de muskola-skeletaj, haŭta-mukozaj kaj seraj perturboj, maloftiĝon kaj malgrandiĝon de akutiĝoj, pliboniĝon de imunologiaj indicoj (malatiĝis titroj de aŭtoantikorpoj, nombro de naivaj kaj aktivigitaj B-limfocitoj kaj plasmoĉeloj, altiĝis koncentriĝo de komponantoj de la komplemento C3 kaj C4). Ĉe multaj pacientoj uzado de belimumabo en dozo 10 mg/kg ebligis malaltigi dozon de glukokortiroidoj je 25%. Aplikado de belimumabo montris ke pacientoj bone akceptas ĝin, nombro de negativaj reagoj kompareblis kun tiuj en placebo-grupo[31][32][33]. Oni preskribas belimumabon kaze de modera aŭ alta aktiveco de lupuso, ĉeesto de klare esprimitaj seraj perturboj (pozitivaj titroj de antinuklea faktoro kaj/aŭ antikorpoj al la duspirala DNA) kaj nesufiĉa efikeco de ordinara terapio. Ĝi rekomendindas ankaŭ kaze de komplika formo de la malsano, kun oftaj akutiĝoj, neceso apliki altajn dozojn de glukokortiroidoj, alta risko de organaj damaĝoj, oftaj infektoj. Oni preskribas ĝin en la dozo 10 mg/kg kaj injektas envejne laŭ jena skemo: 0-14-28 tagoj kaj poste ĉiumonate (post 28 tagoj) dum ne malpli ol ses monatoj[30].
Al la pacientoj kun lupusa nefrito kaj edemoj oni rekomendas maksimume limigi konsumadon de nutraĵoj enhavantaj salon (ĝis 88 miliekvivalentoj de natrio tage, kio egalas al 2 gramoj da salo, do al 1/5 de la kulereto). Volumeno de la konsumata likvaĵo ne devas superi volumenon de urino je pli ol 200-300 ml. Gravas je la komenca etapo de la terapio diagnozi hipovolemion, kies simptomoj estas takikardio, malalta (aŭ submalalta) arteria tensio, signoj de dehidratiĝo, foje abdomenaj doloroj, akva diareo, nivelo de albumino en sero <20 gramoj/litro (ofte <10 gramoj/litro). La ĉefa danĝero kadre de uzado de diuretikoj fare de la pacientoj kun hipovolemia formo de la nefrota sindromo estas kresko de deficito de la sangovolumeno, estiĝo de nefrota (hipovolemia) krizo kaj sekvonta ĝin kolapso. Por tiaj pacientoj preskribi la diuretikojn eblas nur post restarigi angian volumenon per kristalaj aŭ koloidaj solvaĵoj. La pacientoj kun nefrota sindromo kaj edemoj, sed sen klinikaj manifestiĝoj de hipovolemio, inverse bezonas diuretikojn sen uzado de koloidaĵoj kiel anstataŭigiloj.
Kaze de etaj periorbitalaj edemoj kaj edemoj de piedoj, ne necesas diuretika terapio, sufiĉas limigi konsumadon de salo; la diuretika terapio necesas por la malsanuloj kun moderaj kaj fortaj edemoj. Por la pacientoj kun la nefrota sindromo preferindaj kuraciloj estas maŝaj diuretikoj (furosemido, bumetanido, torasemido, etakrina acido). Necesas memori ke la diuretikoj de tiu ĉi grupo kupliĝas kun proteino, do se haveblas proteinurio de nefrota nivelo (≥3,5 gramoj diurne) necesas altigi ilian dozon 2-4-oble. Post ĉesigo de la uzado de tiuj ĉi kuraciloj povas aperi resalto-efiko forme de antinatriurezo. Tiazidaj diuretikoj estas malpli efikaj kaj tiuj kaliŝparaj (spironolaktono, amilorido, triamtereno) estas uzataj por preventi hipokaliemion ĉe kombinita ricevado kun maŝaj kaj tiazidaj diuretikoj. Malkresko de la korpa maso ĉe efika diurezo ne devas superi 1-2 kg tage[34].
La plej ofte preskribata maŝa diuretiko estas furosemido, kiu havas natriuretikan kaj diuretikan efikon same ĉe enbuŝa kaj parenterala ricevado. Ĝi ekefikas jam 30 minutojn post perbuŝa ricevado kaj 5 minutojn post tiu envejna, kaj la efiko daŭras 6-8 horojn. Tamen multaj pacientoj kun nefrota sindromo havas rezistemon al furosemido kaj foje tio okazas malgraŭ altigo de dozo kaj transiro al envejnaj infuzioj po 0,1-1,0 mg/kg/horo unufoje diurne[34].
Antaŭe oni uzis ankaŭ grandajn envejnajn infuziojn de sala solvaĵo de albumino por altigi ĝian koncentriĝon en sango kaj plibonigi respondon al la diuretikoj ĉe la pacientoj kun nefrota sindromo kaj edemoj. Sed nun tiu ĉi taktiko estas pridubata, ĉar la enigita albumino rapide foriras al la intersticia histo kaj eliĝas kun urino. Krome aldona natria ŝarĝo nekompareble superas ĝian ekstrakcion kun urino. Krome infuzio de hiperonkotika (20%) solvaĵo de albumino altigas riskon de pulma edemo kaj stagna kora malsufiĉo. Do oni infuzas albuminon (preferinde sensalan) ĉefe al pacientoj kun drasta hipovolemio kaj hipotensio, kiam necesas rapide altigi volumenon de la cirkulanta sango kaj sangopremon por preventi komplikaĵojn[34]. Estas pridiskutata ebleco kaj neceso kombini sensalan solvaĵon de albumino kaj furosemidon kaze de rezistemo al la diuretikoj, do se mankas respondo al enigo de unu aŭ kelkaj diuretikoj en maksimuma dozo[35][36][37].
Ĉe 35% de la malsanuloj kun nefrota sindromo aperas diversaj tromboembolaj komplikaĵoj pro perdo de antitrombaj faktoroj kun urino. Plej forta kresko de hiperkoaguliĝo okazas ĉe hipoalbunemio <25 gramoj/litro. Por profilakto de tiuj ĉi komplikaĵoj al ĉiuj pacientoj kun nefrota sindromo, speciale kaze de hipoalbunemio <25 gramoj/litro akompananta de interkuranta infektofr kaj/aŭ devigita litkuŝado, necesas preskribi rektajn antikoagulantojn (malaltmolekulajn heparinojn)[36][38]
Lupuso altigas riskon de kardiovaskulaj malsanoj (KVM), pro tio ke pli oftaj iĝas kardiovaskulaj risko-faktoroj, okazas kronika inflamo, kaj pro speciafa terapio, inkluzive per glukokortiroidoj[39][40][41]. Lupusa nefrito ĉe tiaj malsanuloj duoble altigas nombron de aterosklerozaj platoj[42], altigas riskon de korinfarkto kaj de la morto pro KVM — kompare al la pacientoj kun lupuso sed sen lupusa nefrito[43]. Malaltigi la riskon de KVM ĉe la pacientoj kun lupuso kaj lupusa nefrito eblas influante la ŝanĝeblajn kardiovaskulajn risko-faktorojn, inkluzive de: obezeco, hipodinamiko, fumado, arteria hipertensio, hiperlipidemio, diabeto. Gravas ankaŭ subpremo de kronika aŭtoimuna inflamo (atingo de remito de lupusa nefrito), malaltigo de la dozo de glukokortiroidoj ĝis minimume necesa por subteno de la remito (prednisolono ≤7,5 mg diurne)[34].
Praktika strategio de la terapio

Praktika strategio de la terapio de lupusa nefrito devas sekvi jenajn rekomendojn[44].
- Ĉiuj pacientoj kun lupusa nefrito kaj proteinurio ≥0,5 gramoj diurne, speciale se ĝin akompanas hematurio kaj/aŭ ĉelaj cilindroj, kaj malaltigo de malrapidiĝo de glomerula filtrado devas trapasi renan biopsion kun difinado de la klaso, grado de aktiveco/kronikeco de la nefrito kaj de mikroangiopatio. Ripeta rena biopsio estas farinda kaze de akutiĝo de la nefrito aŭ malboniĝo de la sanstato, rezistemo al imunosubprema aŭ biologia terapioj dum unu jaro. La biopsio ebligos eltrovi eventualan ŝanĝon de la morfologia klaso de la nefrito, grado de ĝia aktiveco/kronikeco, aliajn eblajn patologiojn.
- Se dum la indukta terapio estis uzata Cyclophosphamide kaj ne venis respondo, necesas anstataŭigi ĝin per Mycophenolate mofetil. Se estis uzata Mycophenolate mofetil kaj ne venis respondo, necesas anstataŭigi ĝin per Cyclophosphamide kaj aldoni rituksimabon, HEIG, kaze de rapide progresanta nefrito necesas fari plasmaferezon, imunoadsorbon.
- Nepre uzendaj estas hidroksiklorokino (200-400 mg diurne), altaj dozoj de glukokortiroidoj (prednisolono 0,5-1 mg/kg diurne) ne pli ol 2 monatojn, kun posta laŭgrada malaltigo de la dozo post atingo de parta aŭ plena respondo (prednisolono ≤7,5 mg diurne).
- Simptoma terapio devas konsisti el inhibantoj de angiotensintransforma fermento aŭ el blokiloj de receptoroj de angiotensino II ĉe proteinurio >0,5 gramoj diurne kaj/aŭ arteria hipertensio, statinoj (ĉe hiperlipidemio), malaltaj dozoj de aspirino por profilakto de trombaj komplikaĵoj ĉe malsanuloj kun pozitivaj antifosfolipidaj antikorpoj (AFL), antikoagulantoj (ĉe nefrota sindromo kun grava hipoalbunemio, speciale ĉe AFL-pozitivaj pacientoj), kuraciloj kun kalcio kaj vitamino D.
- Post ĉiuj 2-4 semajnoj dum 2-4 monatoj post la diagnozado aŭ post akutiĝo de lupusa nefrito necesas esplori jenajn indicojn: korpomaso, arteria tensio, klinika sangoekzameno, nivelo de kreatinino, albumino, hiperlipidemio, elektrolitoj en sero, proteinurio, eritrociturio, leŭkociturio, cilindrurio, malrapidiĝo de glomerula filtrado. Post 6 monatoj necesas kontroli imunologiajn markilojn de lupuso: koncentriĝo de C3- kaj C4 komponantoj de la komplemento, de antikorpoj al duspirala DNA, de antikorpoj al С1q-komponanto de la komplemento. Plej gravas ne absolutaj indicoj, sed ilia dinamiko. Post atingi partan aŭ plenan respondon oni ripetas la esploradon post ĉiuj 3-6 monatoj.
- Necesas profilakto de la ŝanĝeblaj kardiovaskulaj risko-faktoroj: kontrolo de korpomaso, hipolipidemia dieto, rezigno je fumado, reveno al fizika aktivado post parta aŭ plena respondo al la terapio de lupusa nefrito.
- Unufoje je 12 monatoj necesas eĥokardiografio. Ĉe tio necesas atenti ne nur ŝanĝojn proprajn al lupuso (eblas perikardito, endokardito), sed ankaŭ fruajn prediktorojn de kronika kora malsufiĉo (hipertrofio de miokardo de maldekstra korventriklo, diastola misfunkcio de miokardo, dilato de maldekstra atrio). Se ili estis trovitaj, necesas regule konsulti kardiologon.
Kuracado de lupusa nefrito kaze de gravedeco
Rekomendindas kelkaj variantoj de terapio. Se lupusa nefrito estas neaktiva kaj ne speciale manifestiĝas aliloke, oni povas resti sen speciala terapio. Kaze de malgranda aktiveco de lupusa nefrito rekomendindas aminokinolinaj kuraciloj (hidroksiklorokino). Se lupusa nefrito aktivas aŭ aktive manifestiĝas alilokaj signoj de lupuso, oni preskribas glukokortiroidojn en dozoj, ebligantaj kontroli la malsanon. Kaze de neceso aldoneblas Azathioprine[14].
Memorindas ke altaj dozoj de glukokortiroidoj ĉe la gravedaj malsanuloj estas ligitaj al alta risko de evoluo de alta sangopremo kaj diabeto. Mycophenolate mofetil, Cyclophosphamide, ciklosporino kaj Methotrexate estas ne preskribendaj pro alta risko de evoluo de la teratogena efiko (distordo de la ontogenezo). Teratogenan efikon de Azathioprine en dozoj ne pli ol 2 mg/kg oni konsideras minimuma. Al pacientoj kun persista alte aktiva lupusa nefrito, diagnozitaj aŭ supozitaj klasoj III/IV, oni rekomendas post 28 semajnoj fari Cezaran sekcon[14].
Rekomendoj de EULAR

De 2012 ĝis 2019 la ĉefa gvidilo pri kuracado de lupusa nefrito estis rekomendoj de EULAR/ERA–EDTA (European League Against Rheumatism and European Renal Association — European Dialysis and Transplant Association), aprobitaj en 2012[45].
Dum tiu ĉi periodo aperis pluraj novaj informoj, inkluzive pri uzado de inhibantoj de kalcineŭrino, plurcela terapio, kontrolado de la malsano kaj novaj celoj de la terapio. Do en 2019 la EULAR-komitato eldonis novajn rekomendojn surbaze de opinioj de fakuloj, inter kiuj estis 11 reŭmatologoj, 11 nefrologoj, 1 nekropsiisto, 1 pediatro-reŭmatologo, 1 pediatro-nefrologo, 1 parakuracisto kaj 2 reprezentantoj de pacienta organizo. La komitato serĉis en PubMed publikaĵojn pri la temo aperintajn de januaro 2012 ĝis decembro 2019, pritaksis ilin kaj en majo 2019 rekonsideris la rekomendojn de 2012[46].
En la novaj rekomendoj celoj de la terapio dependas ĉefe de kiom da tempo pasis ekde komenco de la kuracado. Retrospektiva analizo de la esploroj MAINTAIN kaj Euro-Lupus Nephritis Trails montris ke la plej bona kaj sola prognozilo de longdaŭra rezulto de la rena patologio (de risko de fina rena malsufiĉo aŭ duobligo de sera kreatinino 10 jarojn post la malsaniĝo) estas proteinurio post 12 monatoj da kuracado[47][48][49][50]. Do la precipa celo de la kuracado estas malaltigi proteinurion ĝis <0,5–0,7 gramoj diurne antaŭ la 12-a monato (plena klinika respondo), kvankam ĝis 50% de la pacientoj ne atingintaj tiun ĉi signifon, povus havi stabilan renan funkciadon dum longa tempo[48]. Kiel parta klinika respondo estas konsiderata malaltigo de proteinurio kaj stabiligo aŭ normaligo de malrapidiĝo de glomerula filtrado je la 3-a monato de la kuracado kaj almenaŭ duonigo de proteinurio je la 6-a monato[51][52]. Por pacientoj kun nefrota nivelo de proteinurio tiuj ĉi periodoj povus esti altigitaj je 6-12 monatoj pro pli malrapida restarigo de la rena funkciado[53].
Plejparto de la akutiĝoj okazas dum la unuaj 5-6 jaroj de la kuracado, do oni rekomendas al plejparto de la pacientoj ne ĉesigi imunosubpreman terapion dum tiu ĉi periodo. Malaltigi dozojn eblas nur post plena klinika respondo, unuavice malaltigeblas dozoj de glukokortiroidoj[48]. Dum subtena terapio preferindas Mycophenolate mofetil, dum planado de gravedeco — Azathioprine.
Kaze de fina rena malsufiĉo preferindas rena transplantado, prefere preventa, do okazinta antaŭ komenco de la sangodializo. Tio ebligas altigi 10-jaran postvivadon ĝis 94%, dum kaze de peritonea dializo ĝi estas 76%, kaze de sangodializo 42%. Izolita sera aktiveco ne estas obstaklo kiu prokrastigas la operacion, ĉar ĝi ne estas danĝera. Recidivoj en la transplantita reno okazas ege malofte, sed plu estas alta risko de oportunaj infektoj sur la fono de forta imunosubprema terapio.
Fine estis aprobitaj jenaj rekomendoj.
1. Ekzamenado de paciento kun supozebla lupusa nefrito.
1.1. Necesas pritaksi eblecon de la rena biopsio se haveblas simptomoj de renaj damaĝoj, speciale se temas pri persista proteinurio ≥0,5 gramoj diurne (aŭ rilatumo proteino/urina kreatinino (RPUK) ≥500 mg/g je matena urino) kaj/aŭ okazas neklarigebla malaltigo de malrapidiĝo de glomerula filtrado (MGF).
1.2. Rena biopsio estas necesa esplorilo, ĝia diagnoza kaj prognoza signifo ne anstataŭigeblas per iuj ajn aliaj klinikaj aŭ laboratoriaj indicoj.
2. Morfologia pritakso de la rena biopsio.
2.1. Estas rekomendite uzi klasifikojn de la Internacia Societo de Nefrologoj / Internacia Societo de Renaj Patologoj (ISN/RPS) 2003 kun aldona pritakso de indeksoj de aktiveco kaj sklerozo (kronikeco), kaj de trombaj kaj angiaj damaĝoj ligitaj al antifosfolipida sindromo
3. Kaŭzoj por imunosubprema terapio.
3.1. Imunosubpremiloj, preskribataj kune kun glukokortiroidoj, estas rekomenditaj por la klasoj IIIA или IIIA/C (±V) kaj IVA aŭ IVA/C (±V).
3.2. Al la pacientoj kun lupusa nefrito de la klaso V necesas glukokortiroidoj kaj imunosubpremiloj estas rekomenditaj kaze de proteinurio de nefrota nivelo aŭ ĉe RPUK >1000 mg/g, malgraŭ optimuma aplikado de blokiloj de la renina-angiotensina-aldosterona sistemoen (RAAS-blokiloj).
4. Terapio de lupusa nefrito ĉe plenkreskuloj.
Celoj de la terapio
4.1. Celoj de la terapio estas konservado aŭ plibonigado de la renaj funkcioj, akompanata de malaltiĝo de proteinurio almenaŭ je 25% je la tria monato, je 50% je la sesa monato kaj RPUK <500–700 mg/g je la 12-a monato (plena klinika respondo).
4.2. Pacientoj kun proteinurio je la komenco de lupusa nefrito povus bezoni aldone 6 ĝis 12 monatojn por atingi plenan klinikan respondon; tiukaze ne necesas rapide ŝanĝi la terapion se proteinurio malaltiĝas.
Indukta terapio
4.3. Pacientoj kun lupusa nefrito de la klasoj III aŭ IV ± V necesas ricevi Mycophenolate mofetil (2-3 gramoj diurne aŭ mikofenola acido en ekvivalenta dozo) aŭ malaltajn dozojn de Cyclophosphamide forme de envejnaj infuzioj (po 500 mg post ĉiuj 2 semajnoj, sume 6 infuzioj) kune kun glukokortiroidoj, ĉar tiuj ĉi kombinoj havas la plej bonan rilatumon efikeco/tokseco.
4.4. Kombinaĵo de Mycophenolate mofetil (1-2 gramoj diurne aŭ mikofenola acido en ekvivalenta dozo) kun inhibantoj de kalcineŭrino (speciale takrolimuso) servas kiel alternativa reĝimo, speciale por pacientoj kun proteinurio de nefrota nivelo.
4.5. Pacientoj kun alta risko de estiĝo de rena malsufiĉo (malalta MGF, histologie konfirmitaj duonlunoj, fibrinoida nekrozo aŭ grava intersticia inflamo), povas ricevi terapion je reĝimoj indikitaj je la punktoj 4.3–4.4, sed rekomendindas ankaŭ altaj dozoj de Cyclophosphamide (0,5–0,75 gramoj/m² monate dum 6 monatoj).
4.6. Por malaltigo de suma dozo de glukokortiroidoj estas rekomendite uzi envejnan pulso-terapion de metilprednisolono (suma dozo 500-2500 mg depende de akuteco de la malsano) kun posta ricevado de prednisolono perbuŝe (0,3–0,5 mg/kg diurne) ĝis 4 semajnoj kun malaltigo ĝis ≤7,5 mg diurne je la tria-sesa monato.
4.7. Kaze de "pura" lupusa nefrito de la klaso V estas uzata Mycophenolate mofetil (2-3 gramoj diurne aŭ mikofenola acido en ekvivalenta dozo) kune kun pulso-terapio de metilprednisolono (suma dozo 500-2500 mg) kun posta ricevado de prednisolono perbuŝe (20 mg diurne) ĝis 4 semajnoj kun malaltigo ĝis ≤5 mg diurne je la tria monato. Tio estas rekomendita kiel indukta terapio, ĉar tiu ĉi kombino havas la plej bonan rilatumon efikeco/tokseco.
4.8. Alternativaj variantoj de la terapio de lupusa nefrito de la klaso V estas: Cyclophosphamide envejne aŭ inhibantoj de kalcineŭrino (speciale takrolimuso) forme de monoterapio aŭ kune kun Mycophenolate mofetil aŭ mikofenola acido, speciale ĉe pacientoj kun proteinurio de nefrota nivelo.
4.9. Hidroksiklorokino aldonendas je la dozo ≤5 mg/kg diurne kun konsiderado de MGF.
Subtena terapio
4.10. Se sekve de la indukta terapio stato de la paciento pliboniĝis, kadre de subtena imunosubprema terapio estas rekomenditaj Mycophenolate mofetil (1-2 gramoj diurne aŭ mikofenola acido en ekvivalenta dozo), speciale se ili estis uzataj kadre de la indukta terapio aŭ Azathioprine (2 mg/kg diurne), prefere (se estas plana gravediĝo) kune kun malaltaj dozoj de prednisolono (2,5–5 mg diurne) se necesas kontroli la malsanon.
4.11. Laŭgrada ĉesigo de la terapio (unue oni forigas glukokortiroidojn, poste imunosubpremilojn) povas komenciĝi post 3-5 jaroj de la kuracado kaze de plena klinika respondo. Hidroksiklorokino devas esti uzata longdaŭre.
4.12. Daŭrigo de la terapio, ĝia anstataŭigo per inhibantoj de kalcineŭrino aŭ aldono de kalcineŭrino (speciale de takrolimuso) povas esti prikonsiderata rilate la pacientojn kun la "pura" klaso V. Tiukaze oni uzas la plej malaltajn efikajn dozojn (post pritaksi riskon de nefrotokseco).
Refrakta lupusa nefrito
4.13. Se la celoj de la terapio ne estas atingitaj, estas rekomendita skrupula pritakso de eventualaj kialoj, inkluzive tion, ĉu la paciento precize plenumas la kuracistajn preskribojn kaj ĉu estas uzataj adekvataj kuraciloj.
4.14. Kaze de aktiva refrakta/rezistema al la terapio malsano, la kuracado povas esti anstataŭigita per unu el supremenciitaj alternativaj variantoj. Oni povas ankaŭ preskribi rituksimabon (1000 mg je la tagoj 0 kaj 14).
5. Aldona terapio.
5.1. Inhibantoj de angiotension-konvertaj fermentoj kaj blokiloj de angiotensiaj receptoroj estas rekomenditaj por ĉiuj pacientoj kun RPUK >500 mg/g aŭ kun arteria hipertensio.
5.2. Statinoj estas rekomenditaj depende de lipida nivelo kaj post eltrovo de 10-jara kardiovaskula risko surbaze de sistema pritakso de koronaria risko aŭ de aliaj validigitaj iloj.
5.3. Estas rekomenditaj profilakto de ostaj damaĝoj (kalcio kaj derivaĵoj de la vitamino D kaj/aŭ antiresorbaj kuraciloj) kaĵ imunigo per inaktivigitaj vakcinoj por malaltigi ofecon de komplikaĵoj kaŭzitaj de la terapio aŭ la malsano mem.
5.4. Kaze de pozitivaj testoj pri antifosfolipida sindromo kaj depende de ĝia profilo oni povas uzi aspirinon (80-100 mg diurne) konsiderante rilatumon de utilo kaj risko de sangado.
5.5. Terapio per antikoagulantoj estas prikonsiderata kaze de nefrota sindromo kun nivelo de albumino <20 gramoj/litro.
5.6. Belimumabo uzeblas kiel aldona kuracilo (al la jamaj) por akceli malaltigon de la dozo de glukokortiroidoj, kontroli eksterrenajn manifestiĝojn de lupuso kaj malaltigi riskon de eksterrenaj akutiĝoj.
6. Kontrolado kaj prognozo.
6.1. La paciento devas viziti la kuraciston post ĉiuj 2-4 semajnoj dum la unuaj 2-4 monatoj post la diagnozo aŭ post akutiĝo, kaj poste depende de respondo al terapio. Necesas dumviva kontrolado de la renaj kaj eksterrenaj manifestiĝoj kaj akompanaj statoj.
6.2. Se temas pri aktiva nefrito, ĉe ĉiu vizito necesas pritaksi korpomason, arterian tension (inkluzive hejmajn mezuradojn), MGF, nivelon de albumino, proteinurion (RPUK aŭ diurnan proteinurion), eritrociturion aŭ urinajn sedimentaĵojn, kaj kompletan sangoekzamenonen. Kaze de stabila paso de la malsano oni povas fari la ekzamenojn malpli ofte. De tempo al tempo necesas ekzameni nivelon de C3 kaj C4 kaj antikorpoj al duspirala DNA.
6.3. Ripeta rena biopsio necesas en apartaj kazoj: malboniĝo de renaj indicoj, manko de respondo al imunosubprema terapio aŭ gena-inĝenieraj biologiaj kuraciloj (laŭe al la supremenciitaj kriterioj), ĉe akutiĝo, por konfirmi eblan transformiĝon de histologia klaso aŭ ŝanĝojn de indeksoj de aktiveco kaj kronikeco, por ricevi prognozajn informojn kaj eltrovi patologiojn.
7. Taktiko kaze de fina rena malsufiĉo.
7.1. Ĉe la pacientoj kun lupuso povas esti uzataj ĉiuj metodoj de la anstataŭiga rena terapio.
7.2. Preskribo de imunosubpremiloj al la pacientoj kun fina rena malsufiĉo, trapasantaj sangodializon, preskribendas kaze de eksterrenaj manifestiĝoj.
7.3. Preferinda metodo de la anstataŭiga rena terapio estas rena transplantado, farata kaze de manko de aktiveco de klinikaj (dezirinde ankaŭ de la serologiaj) eksterrenaj manifestiĝoj dum almenaŭ 6 monatoj. La rezulto estas pli bona se transplantado okazas de viva donanto kaj kaze de anticipa transplantado.
7.4. Nivelo de antifosfolipida sindromo devas esti difinita dum preparado al la transplantado, ĉar haveblo de antifosfolipida sindromo sekvigas pli altan riskon de trombaj komplikaĵoj en la transplantita reno.
8. Antifosfolipida sindromo kaj lupusa nefrito.
8.1. Al la pacientoj kun nefropatio asociita kun antifosfolipida sindromo oni povas apliki antitrombocitajn kuracilojn kaj antikoagulantojn (aldone al hidroksiklorokino).
9. Lupusa nefrito kaj gravedeco.
9.1. La gravedecon oni povas plani ĉe stabilaj pacientinoj kun neaktiva lupusa nefrito. Prefere RPUK estu <500 mg/g dum antaŭaj 6 monatoj kaj MGF >50 ml/min.
9.2. Necesas plenumi permesitan ĉe la gravedeco terapion per hidroksiklorokino, prednisolono, Azathioprine kaj/aŭ inhibantoj de kalcineŭrino (speciale per takrolimuso) je sekuraj dozoj dum la tuta gravedeco kaj mamnutrado.
9.3. Mycophenolate mofetil aŭ mikofenola acido devas esti forigitaj 3 ĝis 6 monatojn antaŭ la planata koncipo por esti certa ke ne okazos recidivo kaze de aplikado de alternativa reĝimo de imunosubpremado.
9.4. Por profilakto de preeklampsio dum la gravedeco estas rekomendita ricevado de aspirino.
9.5. Necesas pritaksi staton de la pacientinoj post ĉiuj 4 semajnoj, prefere kadre de plurfaka teamo kun akuŝisto-ginekologo kaj reŭmatologo/nefrologo.
9.6. Kaze de gestacaen akutiĝo de lupusa nefrito oni povas plenumi terapion per ĉiuj kombineblaj supremenciitaj kuraciloj kaj ankaŭ pulso-terapion per metilprednisolono depende de la akuteco de la stato.
10. Pediatria terapio.
10.1. Ĉe la infanoj lupusa nefrito pli ofte estiĝas komence de la malsano kaj havas pli akutan pason kun grava kresko de renaj damaĝoj; diagnozado, taktiko de la terapio kaj kontrolado similas al tiuj ĉe la plenkreskuloj.
10.2. Koordinita programo pri transdonado de la infanaj pacientoj al kuracistoj de plenkreskuloj estas grava paŝo por altigi skrupulecon de la plenumado de la terapio kaj plibonigi longdaŭran prognozon.
Plasmaferezo
Plasmaferezo estas ĉiam pli vaste uzata en terapio de lupusa nefrito, kvankam universalaj rekomendoj tiukampe ankoraŭ ne aperis.
Usona Societo de Aferezo rekomendas por kuracado de lupusa nefrito kaj gravaj akutiĝoj de lupuso (difuza alveola sangado ks) apliki plasman interŝanĝon, forigante dum unu proceduro po 1 ĝis 1,5 volumenoj de la cirkulanta plasmo (VCP)[54]. En Eŭropo plasma interŝanĝo estas uzata kiel aldona kuracmetodo de lupusa nefrito rezistema al mikofenola acido kaj Cyclophosphamide, kaj kaze de rapide prograsanta glomerulonefrito kaj ĉe alta aktiveco de lupusa nefrito ĉe gravedulinoj[55]. En Japanio plasma interŝanĝo kaj kaskada plasmafiltrado estas aplikataj ĉe pacientoj kun rapide progresanta glomerulonefrito aŭ lupusa damaĝo de la centra nerva sistemo ĉe malaltigo de la nivelo de komplemento (СН50) ≤20 unuoj aŭ C3-komponanto de la komplemento ≤40 mg/dekalitro aŭ kaze de ekstreme alta nivelo de antikorpoj al DNA kaze de nesufiĉe efika terapio[56]. En Rusio plej ofte estas uzata malgranda plasmaferezo, kiam dum unu proceduro estas forigataj 800 — 1 000 ml de sangoplasmo, do 20-30% VCP, kio malaltigas nivelon de aŭtoantikorpoj ne pli ol je 20% kaj havas dubindan efikecon[57].
La ĉefa malavantaĝo de plasma interŝanĝo estas malalta elektemo je forigado de aŭtoantikorpoj, ĉefe de klaso IgG; por grave malaltigi ilian nivelon necesas dum unu proceduro forigi ne malpli ol 1,5 VCP (por malsanulo 70 kg peza ne malpli ol 4 litrojn). Tio sekvigas gravan perdon de utilaj substancoj kaj necesigas enigon dum la proceduro de altaj dozoj de albumino kaj ĵusfrostigita doninta sangoplasmo. Ĉe tio altiĝas risko de alergiaj reagoj kaj ebleco de sangotransdoneblaj infektoj. Superi tiujn ĉi problemojn ebligas kaskada plasmafiltrado kaj imunoadsorbo.
Ĉe kaskada plasmafiltrado sangoplasmo, ricevata dum centrifuga aŭ membrana plasmaferezo, estas filtrata tra frakciiloj kun poroj 10, 20 aŭ 30 nm grandaj. Sekve de tio ĝi disiĝas je altmolekula frakcio (forigenda) kaj frakcio kun malpli alta molekula maso (inkluzive de albumino, vasta gamo de elektrolitoj, malaltmolekulaj metabolitoj kaj aliaj etaj molekuloj), kiun oni reinfuzas al paciento. Danke al tio eĉ kaze de eksfuzio de >1 VCP tute ne necesas aŭ necesas je malpli granda kvanto rekompenso de albumino kaj koagulfaktoroj. Por efike forigi IgG necesas uzi frakciilojn kun poroj ĝis 10 nm grandaj, por forigi IgM kaj cirkulantajn imunokompleksojn — 30 nm. Oni raportis pri sukcesa uzado de kaskada plasmafiltrado kune kun metilprednisolono ĉe 12 pacientoj kun difuza prolifera lupusa nefrito. Ripeta rena biopsio montris ke lupusa nefrito de la klaso IV transiris al la klasoj II–III[58]. Kaskada plasmafiltrado estas oble pli efika kaj sekura ol plasma interŝanĝo, tamen uzado de frakciiloj de sangoplasmo kun poroj ĝis 10 nm grandaj por forigado de aŭtoantikorpoj de la klaso IgG sekvigas certan perdon de albumino (10-20%) kaj koagulfaktoroj. Kaze de eksfuzio >0,8–1,0 VCP tiuj ĉi perdoj iĝas signifaj kaj altigo de la eksfuzio ĝis 1,5-2 VCP postulas rekompenson de albumino kaj ĵusfrostigita donacinta sangoplasmo.
Ĉe imunoadsorbo celataj molekuloj (kaze de lupuso tio estas imunoglobulinoj kaj cirkulantaj imunokompleksoj) eliĝas el sangoplasmo sekve de ilia kuplado kun speciale aktivaj kemiaj kombinaĵoj (kelatigantoj), senmovigitaj sur surfaco de imunosorbanto. Dum kuracado de la pacientoj kun lupuso kiel kelatigantoj povas servi enilalanino (kolumno Immunosorba-PH®, Asahi Kasei Medical, Japanio)[59], dekstrano sulfato (kolumno Selesorb®, Kaneka, Japanio)[60], stafilokoka proteino A (kolumnoj Immunosorba®, Fresenius Medical Care, Germanio)[61], sintetika peptido GAM® (kolumnoj Globaffin®, Fresenius Medical Care, Germanio)[62], IgG-antikorpoj (kolumnoj Ig-TheraSorb®, Miltenyi Biotec GmbH, Germanio[62][63], «Ig Adsopak®», NPF Pokard, Rusio).
Plej ofte eksterkorpa hemokorektado estas preskribata dum indukta fazo de la terapio por rapide malaltigi nivelon de aŭtoantikorpoj kaj cirkulantaj imunokompleksoj en la sangoplasmo. Por preventi resalto-efikon, kaŭzatan de stimulado de sintezo de aŭtoantikorpoj post ilia rapida forigo, kaj por altigi efikecon de la kuracado, la eksterkorpa hemokorektado estas kombinata kun kuracila terapio (metilprednisolono, Cyclophosphamide, rituksimabo ktp)[21][59]. La kuracado okazas post komenco de la malsano aŭ ĝia akutiĝo. Eblas ankaŭ perioda eksterkorpa hemokorektado; tiukampe la plej sukcesa estas konsiderata protokolo de imunoadsorba kuracado ellaborita de G.H. Stummvoll kaj kunaŭtoroj, kaj daŭranta pli ol unu jaron. Kadre de tiu ĉi skemo estas uzataj regenereblaj imunosorbaj kolumnoj Ig-Therasorb (Miltenyi Biotec, Germanio) aŭ Globaffin (Fresenius Medical Care, Germanio). Cikloj konsistas el po du proceduroj kiuj okazas kun intervalo je 2-3 tagoj kaj ripetiĝas post 3 semajnoj. Dum unu proceduro volumeno de perfuzo de sangoplasmo tra kolumnoj atingas 6-8 litrojn. Iuj pacientoj estas kuracataj laŭ tiu ĉi protokolo jam pli ol 10 jarojn kaj plejparto el ili atingis plenan remiton[62].
Vidu ankaŭ
Referencoj
- ↑ Bastian, H. M.; J. M. Roseman, G. McGwin Jr., G. S. Alarcón, A. W. Friedman, B. J. Fessler, B. A. Baethge, J. D. Reveille (2002). “Systemic lupus erythematosus in three ethnic groups. XII. Risk factors for lupus nephritis after diagnosis”, Lupus (en) 11 (3), p. 152–160. doi:10.1191/0961203302lu158oa. Alirita 2023-03-17..
- ↑ Jakes, Rupert W.; Sang-Cheol Bae, Worawit Louthrenoo, Chi-Chiu Mok, Sandra V. Navarra, Namhee Kwon (2012-02). “Systematic review of the epidemiology of systemic lupus erythematosus in the Asia-Pacific region: prevalence, incidence, clinical features, and mortality”, Arthritis Care & Research (en) 64 (2), p. 159–168. doi:10.1002/acr.20683. Alirita 2023-03-17..
- ↑ Камерон, Дж. С.. (2001) Н.А. Мухин: Волчаночный нефрит и его ведение в 2001 г. // Успехи нефрологии (ruse), p. 145–64. ISBN =.
- ↑ Панафидина, Т.А.; Попкова Т.В. (2018). “Общие принципы лечения волчаночного нефрита с профилактикой сердечно-сосудистых осложнений”, Современная ревматологи (ru) 12 (4), p. 4. doi:10.14412/1996-7012-2018-4-4-8. Alirita 2023-03-22..
- ↑ Краснова, Т. Н. (2008). “Поражение почек при системной красной волчанке: современные представления о патогенезе, клинике, подходы к лечению”, Современная ревматология (ru) 2 (3), p. 18–19. doi:10.14412/1996-7012-2008-483. Alirita 2023-03-20..
- 1 2 3 Краснова, Т. Н. (2008). “Поражение почек при системной красной волчанке: современные представления о патогенезе, клинике, подходы к лечению”, Современная ревматология (ru) 2 (3), p. 18–19. doi:10.14412/1996-7012-2008-483. Alirita 2023-03-20..
- ↑ Wakasugi, Daisuke; Takahisa Gono, Yasushi Kawaguchi, Masako Hara, Yumi Koseki, Yasuhiro Katsumata, Masanori Hanaoka, Hisashi Yamanaka (2012-01). “Frequency of class III and IV nephritis in systemic lupus erythematosus without clinical renal involvement: an analysis of predictive measures” (en) 39 (1), p. 79–85. doi:10.3899/jrheum.110532. Alirita 2023-03-17..
- 1 2 Christopher-Stine, Lisa; Mark Siedner, Janice Lin, Mark Haas, Hemal Parekh, Michelle Petri, Derek M Fine (2007-02). “Renal biopsy in lupus patients with low levels of proteinuria” (en) 34 (2), p. 332–335. Alirita 2023-03-17..
- ↑ Olson, Stephen W.; Jessica J Lee, Lisa K Prince, Thomas P Baker, Patricia Papadopoulos, Jess Edison, Kevin C Abbott (2013-10). “Elevated subclinical double-stranded DNA antibodies and future proliferative lupus nephritis”, Clinical Nephrology (en) 8 (10), p. 1702–1708. doi:10.2215/CJN.01910213. Alirita 2023-03-17..
- ↑ Stojan, G.; M Petri (2016-07). “Anti-C1q in systemic lupus erythematosus”, Lupus (en) 25 (8), p. 873–877. doi:10.1177/0961203316645205. Alirita 2023-03-17..
- ↑ Weixin, Hu; Yinghua Chen, Shaofan Wang, Hao Chen, Zhengzhao Liu, Caihong Zeng, Haitao Zhang, Zhihong Liu (2016-04-07). “Clinical-Morphological Features and Outcomes of Lupus Podocytopathy”, Clinical Nephrology (en) 11 (4), p. 585–592. doi:10.2215/CJN.06720615. Alirita 2023-03-17..
- ↑ Di, Song; Li-hua Wu, Feng-mei Wang, Xiao-wei Yang, Di Zhu, Min Chen, Feng Yu, Gang Liu, Ming-hui Zhao (2013-01-15). “The spectrum of renal thrombotic microangiopathy in lupus nephritis”, Arthritis research & therapy (en) 15 (1). doi:10.1186/ar4142. Alirita 2023-03-17..
- ↑ Bernatsky, S.; J-F Boivin, L Joseph, S Manzi, E Ginzler, D D Gladman, M Urowitz, P R Fortin, M Petri, S Barr, C Gordon, S-C Bae, D Isenberg, A Zoma, C Aranow, M-A Dooley, O Nived, G Sturfelt, K Steinsson, G Alarcón, J-L Senécal, M Zummer, J Hanly, S Ensworth, J Pope, S Edworthy, A Rahman, J Sibley, H El-Gabalawy, T McCarthy, Y St Pierre, A Clarke, R Ramsey-Goldman (2006 (Aŭgusto)). “Mortality in systemic lupus erythematosus”, Arthritis & Rheumatology (en) 54 (8). doi:10.1002/art.21955. Alirita 2023-03-17..
- 1 2 3 4 5 6 7 8 9 Лила, В.А. (2020). “Клинико-лабораторные взаимосвязи у пациентов с различными вариантами течения системной красной волчанки”, Современная ревматология (ru) (1), p. 26. doi:10.14412/1996-7012-2020-1-26-31. Alirita 20-08-2020..
- ↑ Краснова, Т. Н. (2008). “Поражение почек при системной красной волчанке: современные представления о патогенезе, клинике, подходы к лечению”, Современная ревматология (ru) 2 (3), p. 19–20. doi:10.14412/1996-7012-2008-483. Alirita 2023-03-20..
- 1 2 3 Краснова, Т. Н. (2008). “Поражение почек при системной красной волчанке: современные представления о патогенезе, клинике, подходы к лечению”, Современная ревматология (ru) 2 (3), p. 20. doi:10.14412/1996-7012-2008-483. Alirita 2023-03-20..
- ↑ Almaani, Salem; Alexa Meara, Brad H Rovin (2017-05-08). “Update on Lupus Nephritis”, Clinical Journal of the American Society of Nephrology (en) 12 (5), p. 825–835. doi:10.2215/CJN.05780616. Epub 2016 Nov 7. Alirita 2023-03-27..
- ↑ Панафидина, Т.А.; Попкова Т.В. (2018). “Общие принципы лечения волчаночного нефрита с профилактикой сердечно-сосудистых осложнений”, Современная ревматологи (ru) 12 (4), p. 5. doi:10.14412/1996-7012-2018-4-4-8. Alirita 2023-03-22..
- 1 2 3 4 Краснова, Т. Н. (2008). “Поражение почек при системной красной волчанке: современные представления о патогенезе, клинике, подходы к лечению”, Современная ревматология 2 (3), p. 21. doi:10.14412/1996-7012-2008-483. Alirita 2023-03-20..
- ↑ Bertsias, George K.; Maria Tektonidou, Zahir Amoura, Martin Aringer, Ingeborg Bajema, Jo H M Berden, John Boletis, Ricard Cervera, Thomas Dörner, Andrea Doria, Franco Ferrario, Jürgen Floege, Frederic A Houssiau, John P A Ioannidis, David A Isenberg, Cees G M Kallenberg, Liz Lightstone, Stephen D Marks, Alberto Martini, Gabriela Moroni, Irmgard Neumann, Manuel Praga, Matthias Schneider, Argyre Starra, Vladimir Tesar, Carlos Vasconcelos, Ronald F van Vollenhoven, Helena Zakharova, Marion Haubitz, Caroline Gordon, David Jayne, Dimitrios T Boumpas; European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (2012-11). “Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis”, Annals of Rheumatic Diseases (en) 71 (11), p. 1771–1782. doi:10.1136/annrheumdis-2012-201940. Alirita 2023-03-22..
- 1 2 3 4 5 6 Панафидина, Т.А.; Попкова Т.В. (2018). “Общие принципы лечения волчаночного нефрита с профилактикой сердечно-сосудистых осложнений”, Современная ревматологи (ru) 12 (4), p. 6. doi:10.14412/1996-7012-2018-4-4-8. Alirita 2023-03-22..
- 1 2 Лила, А.М.; Трофимов Е.А., Лила В.А. (2015). “Системная красная волчанка: особенности течения у беременных и варианты терапии”, Современная ревматология (ru) 9 (3), p. 45. doi:10.14412/1996-7012-2015-3-43-47. Alirita 20-08-2020..
- ↑ Соловьёв, С. К. (2012). “Внутривенный иммуноглобулин в ревматологической практике”, Доктор.Ру (ru) 2 (70), p. 63–66. Alirita 2023-03-23..
- ↑ (1999-06-25) “Renal Insufficiency and Failure Associated with Immune Globulin Intravenous Therapy -- United States, 1985-1998”, Morbidity and Mortality Weekly Report (en) 48 (24), p. 518–521. Alirita 2023-03-23..
- ↑ Соловьев, С.К.; Асеева Е.А., Торгашина А.В. (2010). “Интенсифицированная терапия аутоиммунных ревматических заболеваний”, Русский медицинский журнал (ru) 18 (11), p. 748–751. Alirita 2023-03-23..
- ↑ van Vollenhoven, Ronald; M. J. Soto, M. J. Cuadrado, M. A. Khamashta (10-2011). “Rituximab — Shadow, illusion or light?”, Autoimmunity reviews (en) (11(8)), p. 563–567. doi:10.1016/j.autrev.2011.10.013. Alirita 27-08-2020..
- ↑ Ramos-Casals, Manuel; M. J. Soto, M. J. Cuadrado, M. A. Khamashta (08-2009). “Rituximab in systemic lupus erythematosus: A systematic review of off-label use in 188 cases”, Lupus (en) (18(9)), p. 767–776. doi:10.1177/0961203309106174. Alirita 27-08-2020..
- ↑ Stohl, William; David M. Hilbert (9-01-2012). “The discovery and development of belimumab: the anti-BLyS-lupus connection”, Nature Biotechnology (en) 30 (1), p. 69–77. doi:10.1038/nbt.2076. Alirita 27-08-2020..
- ↑ Halpern, Wendy G.; Patrick Lappin, Thomas Zanardi, Wendy Cai, Marta Corcoran, John Zhong, Kevin P. Baker (06-2006). “Chronic administration of belimumab, a BLyS antagonist, decreases tissue and peripheral blood B-lymphocyte populations in cynomolgus monkeys: pharmacokinetic, pharmacodynamic, and toxicologic effects”, Toxicological Sciences (en) 91 (2), p. 586–599. doi:10.1093/toxsci/kfj148. Alirita 27-08-2020..
- 1 2 Насонов, Е.Л.; Решетняк Т.М., Денисов Л.Н. и др. (2012). “Белимумаб: прогресс в лечении системной красной волчанки”, Научно-практическая ревматология (ru) 50 (5), p. 13–19. Alirita 27-08-2020..
- ↑ Navarra, Sandra V.; Renato M. Guzmán, Alberto E. Gallacher, Stephen Hall, Roger A. Levy, Renato E. Jimenez, Edmund K.-M. Li, Mathew Thomas, Ho-Youn Kim, Manuel G. León, Coman Tanasescu, Eugeny Nasonov, Joung-Liang Lan, Lilia Pineda, Z John Zhong, William Freimuth, Michelle A. Petri, BLISS-52 Study Group (26-02-2011). “Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial”, The Lancet (en) 377 (9767), p. 721–731. doi:10.1016/S0140-6736(10)61354-2. Alirita 27-08-2020..
- ↑ Furie, Richard; Michelle Petri, Omid Zamani, Ricard Cervera, Daniel J. Wallace, Dana Tegzová, Jorge Sanchez‐Guerrero, Andreas Schwarting, Joan T. Merrill, W. Winn Chatham, William Stohl, Ellen M. Ginzler, Douglas R. Hough, Z. John Zhong, William Freimuth, Ronald F. van Vollenhoven, BLISS‐76 Study Group (12-2011). “A phase III, randomized, placebo‐controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus†”, Arthritis & Rheumatology (en) 63 (12), p. 3918–3930. doi:10.1002/art.30613. Alirita 27-08-2020..
- ↑ Клюквина, Н.Г. (2013). “Опыт длительного применения белимумаба у больного системной красной волчанкой (описание случая)”, Современная ревматология (ru) 7 (2), p. 62–65. doi:10.14412/1996-7012-2013-2384. Alirita 20-08-2020..
- 1 2 3 4 Панафидина, Т.А.; Попкова Т.В. (2018). “Общие принципы лечения волчаночного нефрита с профилактикой сердечно-сосудистых осложнений”, Современная ревматологи (ru) 12 (4), p. 7. doi:10.14412/1996-7012-2018-4-4-8. Alirita 2023-03-22..
- ↑ Козловская, Л.; Бобкова И., Фомин В. (2010). “Почечные отеки: механизмы развития, принципы лечения”, Врач (ru), p. 14–16. Alirita 2023-03-24..
- 1 2 Charlesworth, John A; David M Gracey, Bruce A Pussell (2008-02). “Adult nephrotic syndrome: non-specific strategies for treatment” (en) 13 (1), p. 45–50. doi:10.1111/j.1440-1797.2007.00890.x. Alirita 2023-03-24..
- ↑ Duffy, Margaret; Shashank Jain, Nicholas Harrell, Neil Kothari, Alluru S Reddi (2015-10-07). “Albumin and Furosemide Combination for Management of Edema in Nephrotic Syndrome: A Review of Clinical Studies”, Cells (en) 4 (4), p. 622–630. doi:10.3390/cells4040622. Alirita 2023-03-24..
- ↑ Rabelink, T J; J J Zwaginga, H A Koomans, J J Sixma (1994-08). “Thrombosis and hemostasis in renal disease”, Kidney International (en) 46 (2), p. 287–296. doi:10.1038/ki.1994.274. Alirita 2023-03-24..
- ↑ Aviña-Zubieta, J Antonio; Fergus To, Kateryna Vostretsova, Mary De Vera, Eric C Sayre, John M Esdaile (2017-06). “Risk of Myocardial Infarction and Stroke in Newly Diagnosed Systemic Lupus Erythematosus: A General Population-Based Study”, Arthritis Care Res (Hoboken) (en) 69 (6), p. 849–856. doi:10.1002/acr.23018. Epub 2017 May 9. Alirita 2023-03-24..
- ↑ Tselios, Konstantinos; Dafna D Gladman, Jiandong Su, Olga Ace, Murray B Urowitz (2017-12). “Evolution of Risk Factors for Atherosclerotic Cardiovascular Events in Systemic Lupus Erythematosus: A Longterm Prospective Study”, The Journal of Rheumatology (en) 44 (12), p. 1841–1849. doi:10.3899/jrheum.161121. Epub 2017 Nov 1. Alirita 2023-03-24..
- ↑ Насонов, Е.Л.; Попкова Т.В., Новикова Д.С. (2016). “Сердечно-сосудистая патология при ревматических заболеваниях”, Терапевтический архив (ru) 88 (5), p. 4–12. doi:10.17116/terarkh20168854-12. Alirita 2023-03-24..
- ↑ Gustafsson, Johanna T.; Marie Herlitz Lindberg, Iva Gunnarsson, Susanne Pettersson, Kerstin Elvin, John Öhrvik, Anders Larsson, Kerstin Jensen-Urstad, Elisabet Svenungsson (2017). “Excess atherosclerosis in systemic lupus erythematosus,—A matter of renal involvement: Case control study of 281 SLE patients and 281 individually matched population controls”, PLOS ONE (en) 12 (4). doi:10.1371/journal.pone.0174572. Alirita 2023-03-24..
- ↑ Hermansen, Marie-Louise; Jesper Lindhardsen, Christian Torp-Pedersen, Mikkel Faurschou, Søren Jacobsen (2017). “The risk of cardiovascular morbidity and cardiovascular mortality in systemic lupus erythematosus and lupus nephritis: a Danish nationwide population-based cohort study”, Rheumatology (Oxford, England) (en) 56 (5), p. 709–715. doi:10.1093/rheumatology/kew475. Alirita 2023-03-24..
- ↑ Панафидина, Т.А.; Попкова Т.В. (2018). “Общие принципы лечения волчаночного нефрита с профилактикой сердечно-сосудистых осложнений”, Современная ревматологи (ru) 12 (4), p. 7–8. doi:10.14412/1996-7012-2018-4-4-8. Alirita 2023-03-22..
- ↑ (2012-11) “Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis”, Annals of Rheumatic Diseases (en) 71 (11), p. 1771–1782. doi:10.1136/annrheumdis-2012-201940. Epub 2012 Jul 31. Alirita 2023-03-27..
- ↑ Козловская, Н. Л.; С. К. Соловьев, Е. А. Асеева, Т. В. Попкова, Т. А. Панафидина, Е. Л. Насонов, А. М. Лила, А. А. Меснянкина, Н. Ю. Никишина (2020). “Обновленные рекомендации EULAR/ERA–EDTA 2019 г. по терапии волчаночного нефрита. Комментарии экспертов. Часть I” (ru) 14 (4), p. 8. doi:10.14412/1996-7012-2020-4-7-15. Alirita 2023-03-27..
- ↑ Dall'Era, Maria; Miriam G Cisternas, Dawn E Smilek, Laura Straub, Frédéric A Houssiau, Ricard Cervera, Brad H Rovin, Meggan Mackay (2015-05). “Predictors of long-term renal outcome in lupus nephritis trials: lessons learned from the Euro-Lupus Nephritis cohort”, Arthritis & Rheumatology (en) 67 (5), p. 1305–1313. doi:10.1002/art.39026. Alirita 2023-04-05..
- 1 2 3 Tamirou, Farah; David D'Cruz, Shirish Sangle, Philippe Remy, Carlos Vasconcelos, Christoph Fiehn, Maria del Mar Ayala Guttierez, Inge-Magrethe Gilboe, Maria Tektonidou, Daniel Blockmans, Isabelle Ravelingien, Véronique le Guern, Geneviève Depresseux, Loïc Guillevin, Ricard Cervera, Frédéric A Houssiau; MAINTAIN Nephritis Trial Group (2016-03). “Long-term follow-up of the MAINTAIN Nephritis Trial, comparing azathioprine and mycophenolate mofetil as maintenance therapy of lupus nephritis”, Annals of Rheumatic Diseases (en), p. 526–531. doi:10.1136/annrheumdis-2014-206897. Epub 2015 Mar 10. Alirita 2023-04-05..
- ↑ Tamirou, Farah; Bernard R Lauwerys, Maria Dall'Era, Meggan Mackay, Brad Rovin, Ricard Cervera, Frédéric A Houssiau; MAINTAIN Nephritis Trial Investigators (2015-11-12). “A proteinuria cut-off level of 0.7 g/day after 12 months of treatment best predicts long-term renal outcome in lupus nephritis: data from the MAINTAIN Nephritis Trial”, Lupus Science & Medicine (en) 2 (1), p. e000123. doi:10.1136/lupus-2015-000123. eCollection 2015. Alirita 2023-04-05..
- ↑ Mackay, Meggan; Maria Dall'Era, Joanna Fishbein, Kenneth Kalunian, Martin Lesser, Jorge Sanchez-Guerrero, Deborah M Levy, Earl Silverman, Michelle Petri, Cristina Arriens, Edmund J Lewis, Stephen M Korbet, Fabrizio Conti, Vladimir Tesar, Zdenka Hruskova, Eduardo F Borba, Eloisa Bonfa, Tak Mao Chan, Manish Rathi, K L Gupta, Vivekanand Jha, Sarfaraz Hasni, Melissa R West, Neil Solomons, Frederic A Houssiau, Juanita Romero-Diaz, Juan Mejia-Vilet, Brad H Rovin (2019-03). “Establishing Surrogate Kidney End Points for Lupus Nephritis Clinical Trials: Development and Validation of a Novel Approach to Predict Future Kidney Outcomes”, Arthritis & Rheumatology (en) 71 (3), p. 411–419. doi:10.1002/art.40724. Epub 2019 Feb 1. Alirita 2023-04-05..
- ↑ Dall'Era, Maria; David Stone, Victoria Levesque, Miriam Cisternas, David Wofsy (2011-03). “Identification of biomarkers that predict response to treatment of lupus nephritis with mycophenolate mofetil or pulse cyclophosphamide”, Arthritis Care Res (Hoboken) (en) 63 (3), p. 351–357. doi:10.1002/acr.20397. Epub 2010 Nov 15. Alirita 2023-04-05..
- ↑ Dall'Era, Maria; Victoria Levesque, Neil Solomons, Matt Truman, David Wofsy (2015-05-20). “Identification of clinical and serological factors during induction treatment of lupus nephritis that are associated with renal outcome”, Lupus Science & Medicine (en) 2 (1), p. e000089. doi:10.1136/lupus-2015-000089. eCollection 2015. Alirita 2023-04-05..
- ↑ Touma, Zahi; Murray B Urowitz, Dominique Ibañez, Dafna D Gladman (2014-04). “Time to recovery from proteinuria in patients with lupus nephritis receiving standard treatment”, The Journal of Rheumatology (en) 41 (4), p. 688–697. doi:10.3899/jrheum.130005. Epub 2014 Jan 15. Alirita 2023-04-05..
- ↑ Padmanabhan, Anand; Laura Connelly-Smith, Nicole Aqui, Rasheed A Balogun, Reinhard Klingel, Erin Meyer, Huy P Pham, Jennifer Schneiderman, Volker Witt, Yanyun Wu, Nicole D Zantek, Nancy M Dunbar, Guest Editor Joseph Schwartz (2019-06). “Guidelines on the Use of Therapeutic Apheresis in Clinical Practice - Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue”, The Journal of Clinical Apheresis (en) 34 (3), p. 171–354. doi:10.1002/jca.21705. Alirita 2023-04-05..
- ↑ Bertsias, George K.; Maria Tektonidou, Zahir Amoura, Martin Aringer, Ingeborg Bajema, Jo H M Berden, John Boletis, Ricard Cervera, Thomas Dörner, Andrea Doria, Franco Ferrario, Jürgen Floege, Frederic A Houssiau, John P A Ioannidis, David A Isenberg, Cees G M Kallenberg, Liz Lightstone, Stephen D Marks, Alberto Martini, Gabriela Moroni, Irmgard Neumann, Manuel Praga, Matthias Schneider, Argyre Starra, Vladimir Tesar, Carlos Vasconcelos, Ronald F van Vollenhoven, Helena Zakharova, Marion Haubitz, Caroline Gordon, David Jayne, Dimitrios T Boumpas; European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (2012-11). “Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis”, Annals of Rheumatic Diseases (en) 71 (11), p. 1771–1782. doi:10.1136/annrheumdis-2012-201940. Epub 2012 Jul 31. Alirita 2023-04-05..
- ↑ Соколов, А. А.; А. С. Мануилов, С. Н. Бардаков, В. В. Тишко, А. Н. Бельских, О. Ю. Стрельникова, Т. В. Булгакова (2020). “Программная иммуносорбция с регенерацией сорбционных колонок при лечении волчаночного нефрита”, Современная ревматология (ru) 14 (3), p. 112. doi:10.14412/1996-7012-2020-3-111-116. Alirita 2023-04-05..
- ↑ Асеева, Е. А.; С. К. Соловьев, Т. В. Попкова, Н. Ю. Никишина, А. А. Меснянкина (2019). “Ведение пациентов с системной красной волчанкой в реальной клинической практике”, Научно-практическая ревматология (ru) 57 (2), p. 194. doi:10.14412/1995-4484-2019-191-196. Alirita 2023-04-05..
- ↑ Li, MinXia; YuanDa Wang, Qiang Qiu, RiBao Wei, YuWei Gao, Li Zhang, Yong Wang, XueGuang Zhang, XiangMei Chen (2016-08). “Therapeutic effect of double-filtration plasmapheresis combined with methylprednisolone to treat diffuse proliferative lupus nephritis”, The Journal of Clinical Apheresis (en) 31 (4), p. 375–380. doi:10.1002/jca.21408. Epub 2015 May 28. Alirita 2023-04-05..
- 1 2 Yamaji, Ken; Young-Joon Kim, Hiroshi Tsuda, Yoshinari Takasaki (2008-08). “Long-term clinical outcomes of synchronized therapy with plasmapheresis and intravenous cyclophosphamide pulse therapy in the treatment of steroid-resistant lupus nephritis”, Therapeutic Apheresis and Dialysis (en) 12 (4), p. 298–305. doi:10.1111/j.1744-9987.2008.00591.x. Alirita 2023-04-06..
- ↑ Stefanutti, Claudia; Antonio Vivenzio, Serafina Di Giacomo, Maura Mareri, Fulvia Ceccarelli, Guido Valesini (2005). “Cyclophosphamide and immunoadsorption apheresis treatment of lupus nephritis nonresponsive to drug therapy alone”, BioDrugs (en) 19 (2), p. 129–133. doi:10.2165/00063030-200519020-00004. Alirita 2023-04-06..
- ↑ Braun, N.; C Erley, R Klein, I Kötter, J Saal, T Risler (2000-09). “Immunoadsorption onto protein A induces remission in severe systemic lupus erythematosus”, Nephrology Dialysis Transplantation (en) 15 (9), p. 1367–1372. doi:10.1093/ndt/15.9.1367. Alirita 2023-04-06..
- 1 2 3 Stummvoll, Georg H.; Sabine Schmaldienst, Josef S Smolen, Kurt Derfler, Peter Biesenbach (2012-02). “Lupus nephritis: prolonged immunoadsorption (IAS) reduces proteinuria and stabilizes global disease activity”, Nephrology Dialysis Transplantation (en) 27 (2), p. 618–626. doi:10.1093/ndt/gfr239. Epub 2011 May 26. Alirita 2023-04-06..
- ↑ Stummvoll, G.; M Aringer, J Smolen, S Schmaldienst, E Jimenez-Boj, W Horl, W Graninger, K Derfler (2005-07). “IgG immunoadsorption reduces systemic lupus erythematosus activity and proteinuria: a long term observational study”, Annals of Rheumatic Diseases (en) 64 (7), p. 1015–1021. doi:10.1136/ard.2004.029660. Alirita 2023-04-06..