| Kempferolo | ||||
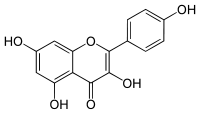 | ||||
| Plata kemia strukturo de la Kempferolo | ||||
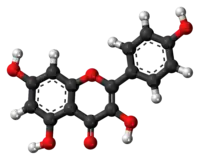 | ||||
| Tridimensia kemia strukturo de la Kempferolo | ||||
 | ||||
| Kempferolo estas solida antioksidigaĵo trovata en plantoj tia kia la brokolo[1] | ||||
 | ||||
| Blankaj kristaloj de kempferolo. | ||||
 | ||||
| Numerigo de la karbonaj strukturoj de la flavonoj. | ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 520-18-3 | |||
| ChemSpider kodo | 4444395 | |||
| PubChem-kodo | 5280863 | |||
| Merck Index | 15,5322 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blanka aŭ flava solidaĵo | |||
| Molmaso | 286,24 g·mol−1 | |||
| Denseco | 1,2981g cm−3 | |||
| Fandpunkto | 276 °C−278 °C[2] | |||
| Bolpunkto | 582,1 °C[3] | |||
| Refrakta indico | 1,4413 | |||
| Ekflama temperaturo | 240,7 °C[4] | |||
| Acideco (pKa) | 6,38 | |||
| Solvebleco | Akvo:Nesolvebla | |||
| Mortiga dozo (LD50) | 500 mg/kg (buŝe)[5] | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R25 R36/37/38 R68 | |||
| Sekureco | S22 S26 S36 S36/37 S36/37/37 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Averto | |||
| GHS Deklaroj pri damaĝoj | H301, H315, H319, H335, H341 | |||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P261, P264, P270, P271, P280, P281, P301+310, P302+352, P304+340, P305+351+338, P308+313, P321, P330, P332+313, P337+313, P362, P403+233, P405, P501[6] | |||
(25 °C kaj 100 kPa) | ||||
Kempferolo, (3,4′,5,7-kvarhidrokso-flavono) aŭ C15H10O6 estas natura flavonolo, el la familio de la flavonoidoj, blanka aŭ flava solidaĵo, nesolvebla en akvo sed solvebla en etanolo, kloroformo, duetila etero, benzeno acetono, "dumetila formamido", DMSO kaj alkalaj solvaĵoj. Kempferolo estas antiinflama kaj antioksidiga kemiaĵo krom esti neŭrono-protektiva.
Ĝi apartenas al la familio de la flavonoidoj kaj ĉeestas en multaj fruktoj, vegetaloj, kaj herboj tiaj kiaj ruĝaj vinberoj, "Ginkgo biloba", pomeloj, diversaj specioj de brasikoj, kiel brokoloj kaj burĝonbrasikoj, pasifloroj, pomoj, tomatoj, verda teo, terpomoj, cepoj, kukurboj, kukumoj, laktukoj, persikoj, framboj, spinaco, aloo vera kaj vasta gamo da aliaj vegetaloj.
La flavonoido ricevis tiun nomon omaĝe al la germana kuracisto kaj botanikisto Engelbert Kaempfer (1651-1716) kiu unue priskribis ĝin.[7][8] Ĉi tiu biologie aktiva komponaĵo elmontras multajn farmakologiajn aktivecojn, tiaj kiaj antioksidigaj, antiinflamaj, antimikrobaj, antidiabetaj kaj antikarcinomogenaj aktivecoj.
La antikanceraj proprecoj de la kempferolo estas raportataj en kancerĉeloj elde malsamaj organoj inklude de brusto, ovarioj, intestoj, pulmoj, pankreata kancero kaj leŭkemio. En la kanceraj ĉeloj de la brusto kempferolo induktas al apoptozo per inhibado de la angiogenezo (aŭ kreado de novaj kanceraj sangaj vejnoj).
| Produktado de kempferolo ekde la ŝikimata acido:[9] |
 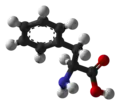 [10]2 [10]2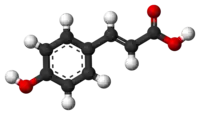 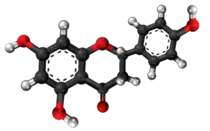 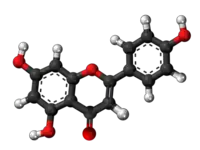  |
Sintezoj
Sintezo 1
- Preparado ekde la akacetino per anstataŭado de la metoksila grupo je hidroksila grupo en la 4-a pozicio de la fenila grupo kaj aldono de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Sintezo 2
- Preparado ekde la apigenino per aldono de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Sintezo 3
- Preparado ekde la krizino per aldono de du hidroksilaj grupoj, unu en la 4-a pozicio de la fenila grupo kaj alia en la 3-a pozicio de la kromenonila grupo:
|
|
Sintezo 4
- Preparado ekde la kverketino per forigo de unu hidroksila grupo en la 5-a pozicio de la fenila grupo:
|
|
Sintezo 5
- Preparado ekde la luteolino per forigo de unu hidroksila grupo en la 5-a pozicio de la fenila grupo kaj aldono de unu hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Sintezo 6
- Preparado ekde la miriketino per forigo de du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo:
|
|
Sintezo 7
- Preparado ekde la naringenino per aldono de unu hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Reakcioj
Reakcio 1
- Konvertado al akacetino per anstataŭado de la hidroksila grupo je metoksila grupo en la 4-a pozicio de la fenila grupo kaj forigo de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Reakcio 2
- Konvertado al apigenino per forigo de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Reakcio 3
- Konvertado al krizino per forigo de du hidroksilaj grupoj, unu en la 4-a pozicio de la fenila grupo kaj alia en la 3-a pozicio de la kromenonila grupo:
|
|
Reakcio 4
- Konvertado al kverketino per aldono de unu hidroksila grupo en la 5-a pozicio de la fenila grupo:
|
|
Reakcio 5
- Konvertado al luteolino per aldono de unu hidroksila grupo en la 5-a pozicio de la fenila grupo kaj forigo de unu hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Reakcio 6
- Konvertado al miriketino per aldono de du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo:
|
|
Reakcio 7
- Konvertado al naringenino per forigo de unu hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|