| Kalia sulfato | ||
 | ||
| Bastona kemia strukturo de la Kalia sulfato | ||
 | ||
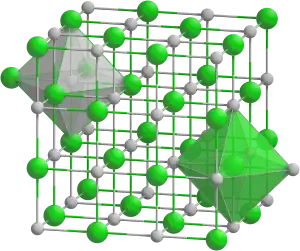
| Tridimensia kemia strukturo de la Kalia sulfato | ||
 | ||
| Arkanito:erco de kalia sulfato. | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | 7778-80-5 | |
| ChemSpider kodo | 22915 | |
| PubChem-kodo | 24507 | |
| Merck Index | 15,7793 | |
| Fizikaj proprecoj | ||
| Aspekto | blankaj senodoraj kristaloj | |
| Molmaso | 174.259 g·mol−1 | |
| Denseco | 2.66g cm−3 | |
| Fandpunkto | 1067 °C | |
| Bolpunkto | 1689 °C | |
| Refrakta indico | 1,4957 | |
| Acideco (pKa) | 4.76 | |
| Solvebleco | Akvo:111 g/L | |
| Mortiga dozo (LD50) | 6600 mg/kg (buŝe) | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H302, H315, H319, H335[1] | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P270, P271, P280, P301+312, P302+352, P304+340, P305+351+338, P312, P321, P330, P332+313, P337+313, P362, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Kalia sulfato estas blanka neorganika kalia salo de sulfata acido, nature trovata sub la nomo arkanito kaj konata en la antikveco kiel "Kali Sulphuricum".[2] Kiam kalia sulfato varmiĝas kun akvo, aŭ kiam agitata en flakono, la kristaloj estigas multebranĉan spiralan strukturon ĉe deponiĝo.
Kalia sulfato povas esti karakterizata por la esploroj pri spiralaj strukturoj en laboratorio. Kalia sulfato uzatas en la produktado de sterkoj (provizante plantojn kaj vegetalojn per kalio kaj sulfuro), kalia aluno, kalia karbonato kaj vitro-fabrikado. En analiza kemio, ĝi uzatas por la identigo de la nitrogeno per la Kjeldahl Metodo kaj de proteinoj en nutraĵoj.
Ĝi same uzatas pri la elektrostataj efikoj sur pKa valoroj por fragmentoj de aminoacidoj en la stafilokoka nukleazo. Ĝi ankaŭ utilas por separado de proteino per elektroforezo k uzatas kiel kemia reakcianto en laboratorio.
Kalia sulfato estas konata ekde la 14-a jarcento kaj estis studata de Johann Rudolph Glauber (1604-1670), Robert Boyle (1627-1691) kaj Otto Tachenius (1610-1680). Ĝi ricevis plurajn latinajn nomojn samkiel polychrestum Glaseri omaĝe al la apotekisto de la 17-a jarcento Christopher Glaser (1615-1678).
Sintezo
Sintezo 1
- Procezo Mannheim: Historie, kalia sulfato estas preparata per agado de la kalia klorido sur sulfata acido:
Tamen, kun la tempopaso kaj la kosto de la klorida acido en la procezo, aliaj naturaj procezoj estis malkovritaj malaltigante la kostojn kaj malpliigante la operaciajn procezojn.
Sintezo 2
Kalia sulfato ankaŭ prepareblas per endoterma reakcio de la kalia bisulfato kaj kalia klorido:[3]
Sintezo 3
Kalia sulfato povas prepariĝi ankaŭ per reakci inter akva solvaĵo de sulfura duoksido, oksigeno kaj kalia klorido:
Sintezo 4
Alternative, kalia sulfato povas prepariĝi per reakcio inter akva solvaĵo de sulfura duoksido, oksigeno kaj kalia klorido:
Reakcio
- Kalia sulfato kaj aluminia sulfato fandiĝas por doni belajn kristalojn trovatajn en la naturo, konatajn kiel alunon:
-180767.jpg.webp) Aluno de kalio kaj aluminio | |
Literaturo
- Chemical Book
- Merck Millipore
- Toxnet
- NIST Webbook
- Chemical Fertilizers: Proceedings of the XVII International Congress ..., Giacomo Fauser
- Industrial Minerals & Rocks: Commodities, Markets, and Uses, Jessica Elzea Kogel
- Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner
Vidu ankaŭ
Referencoj
- ↑ Pubchem
- ↑ The Biochemic System of Medicine, George W. Carey
- ↑ Fertilizer Manual, UN Industrial Development Organization,Int'l Fertilizer Development Center
| ||||||