| Kalia okzalato | |||
 | |||
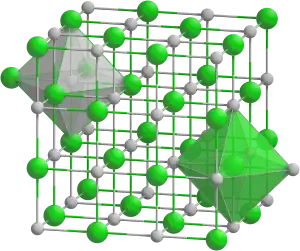
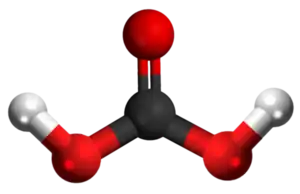
| Plata kemia strukturo de la Kalia okzsalato | |||
 | |||
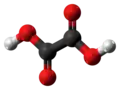
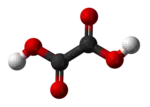
| Tridimensia kemia strukturo de la Kalia okzalato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 583-52-8 | ||
| ChemSpider kodo | 10933 | ||
| PubChem-kodo | 11413 | ||
| Merck Index | 15,7772 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora senodora solidaĵo | ||
| Molmaso | 166,215 g·mol-1 | ||
| Denseco | 2,127g cm−3[1] | ||
| Fandpunkto | 160 °C | ||
| Bolpunkto | 360 °C | ||
| Solvebleco | Akvo:392 g/L [2] | ||
| Mortiga dozo (LD50) | 660 mg/kg (buŝe)[3] | ||
| Sekurecaj Indikoj | |||
| Riskoj | R21 R22 R34 | ||
| Sekureco | S2 S24 S25 S26 S36/37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H302, H312 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P270, P280, P301+312, P302+352, P312, P330, P363, P501[4] | ||
(25 °C kaj 100 kPa) | |||
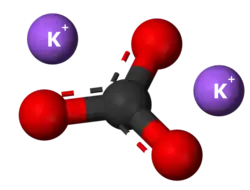
Kalia okzalato aŭ C2K2O4 estas organika kalia salo de okzalata acido, blanka senodora solidaĵo okazanta en multaj plantoj kaj vegetaloj. En akva solvaĵo ĝi estigas fortan dukkarboksilatan acidon, kiu estas produktata ankaŭ en la homa korpo per metabolo de la glioksilata acido aŭ askorbata acido. Ĝi ne estas metaboligita sed estas eliminita en la urino. Ĝi estas uzata kiel analiza reakcianto kaj ĝenerala reduktagento.
Okzalatoj estas kaj konsumita kaj produktita de la homa metabolo. Okzalato ne estas nutraĵo, nek necesa por la homa vivo. Dum plantoj, fungoj kaj algoj produktas kaj trovas uzon por ĝi, ne ekzistas konata uzo por okzalatoj en homoj. Verdire, okzalatoj estas historie konataj kiel anti-nutraĵo pro ĝia kapableco ligiĝi kun kalcio, magnezio, zinko, fero kaj aliaj esencaj mineraloj en la gastrointesta sistemo kaj redukti ilian absorbadon, kontribuante por la minerala malpliigo.[5] Do, okzalatoj devas eliminiĝi de la gastrointesta sistemo kaj la eliminigo okazas ĉefe en la rena sistemo.
Sintezoj
Sintezo 1
- Preparado per traktado de oksalata acido kaj kalia hidroksido:
|
|
Sintezo 2
- Preparado per traktado de "oksalata anhidrido" kaj natria hidroksido:
|
|
Sintezo 3
- Preparado per traktado de oksalata acido kaj kalia karbonato:
|
2 |
Sintezo 4
- Preparado per traktado de kalia klorido kaj etila oksalato:
|
2 |
Sintezo 5
- Preparado per interagado de metila oksalato kaj kalia formiato:
|
|
Sintezo 6
- Preparado per acida interŝanĝo de oksalata acido kaj kalia acetato:
|
|
Sintezo 7
- Preparado per alkohola interŝanĝo de izopropila oksalato kaj kalia hidroksido:
|
|
Reakcioj
Reakcio 1
- Hidrolizo de la kalia oksalato
|
|
Reakcio 2
- Reakcio kun karbonata acido:
|
|
Reakcio 3
- Preparado de kalia buterato per acida interŝanĝo inter kalia oksalato kaj buterata acido:
|
|
Reakcio 4
- Preparado de metila oksalato per alkohola interŝanĝo de kalia oksalato kaj metanolo en acida medio:
|
|
Reakcio 5
- Reduktigo de la kalia oksalato
|
|
Reakcio 6
- Reakcio kun kloramino
|
|
Reakcio 7
- Reakcio kun klorida acido:
|
|
Reakcio 8
- Kalia okzalato reakcias kun fera (III) klorido por estigi feran (III) okzalaton kaj kalian kloridon:
|
3 |
Reakcio 9
- Kalia okzalato reakcias kun kalcia hidroksido por estigi kalcian okzalaton kaj kalian hidroksidon:
|
|
Literaturo
- Scholar Chemistry
- SchiChem Arkivigite je 2018-10-13 per la retarkivo Wayback Machine
- Nile Chemicals
- NIST National Institute of Standards and Technology]
- American Elements
- Merck Group
Referencoj
- ↑ Loba Chemie
- ↑ Merck Millipore
- ↑ Thermo Fisher. Arkivita el la originalo je 2018-10-13. Alirita 2018-10-13.
- ↑ Pubchem
- ↑ Pocket Guide to Kidney Stone Prevention
| ||||||
| ||||||







.oxalate_3D.png.webp)