| Etila jodido | ||||
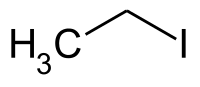 | ||||
| Plata kemia strukturo de la Etila jodido | ||||
 | ||||
| Tridimensia kemia strukturo de la Etila jodido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 75-03-6 | |||
| ChemSpider kodo | 6100 | |||
| PubChem-kodo | 6340 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora lumsensiva likvaĵo | |||
| Molmaso | 155.97g·mol-1 | |||
| Denseco | 1.940g cm−3 | |||
| Fandpunkto | −108 °C | |||
| Bolpunkto | 71 °C | |||
| Refrakta indico | 1,5137 | |||
| Ekflama temperaturo | 72 °C | |||
| Solvebleco | Akvo:4 g/L | |||
| Mortiga dozo (LD50) | 6450 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R20 R36/37/38 R42/43 R10 R23/24/25 R22 | |||
| Sekureco | S23 S26 S36/37 S45 S37/39 S16 S36/37/39 S27 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[1][2] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝo | |||
| GHS Deklaroj pri damaĝoj | H302, H315, H317, H319, H334, H335 | |||
| GHS Deklaroj pri antaŭgardoj | P261, P280, P305, P311, P338, P342, P351 | |||
(25 °C kaj 100 kPa) | ||||
Etila jodido estas senkolora, brulema kemia komponaĵo, kemia formulo C2H5I, preparata per varmigo de la etanolo kun jodo kaj fosforo. Ĉe kontakto kun la aero , ĉefe sub lumefiko, ĝi malkomponiĝas kaj iĝas flava aŭ ruĝeca pro la dissolvita jodo.
Ĝi same prepariĝas per reakcio inter la jodida acido kaj etanolo sekvata per distilado de la jodido de etilo. Ĉi-komponaĵo devas enstoriĝi meze de kupra pulvoro por eviti malkomponiĝon, kvankam eĉ per tiu metodo ĝiaj specimenoj daŭras malpli ol unu jaron.
Ĉar etila jodido estas bona volatila grupo, ĝi plenumas bonan rolon kiel etiligagenton kaj uzatas ankaŭ kiel promocianto de hidrogena radikalo. Ĉi-substanco malheliĝas kontakte kun la aero pro liberigo de jodo.
Sintezoj
Sintezo 1
- Jodido de etilo estas preparata per interagado de la etano sur jodida acido:
| : |
Sintezo 2
- Jodido de etilo estas preparata per interagado de la etanolo sur fosfora trijodido:
|
Reakcioj
Reakcio 1
- Etila jodido reakcias kun amoniako por doni duetilaminon sub alta temperaturo kaj premo:
 |
Reakcio 2
- Trietilamino estiĝas se la supra reakcio daŭre agas inter la duetilamino kaj la etila jodido:
 |
Reakcio 3
- Reakcio inter la trietanolamino kaj etila jodido estigas kvarternaran salon de amonio kaj jodo, konata kiel tetraetilaamonia jodido:
 |
Literaturo
- Chemicalland21
- Purification of Laboratory Chemicals, W. L. F. Armarego, Christina Chai
- Introduction to Spectroscopy, Donald L. Pavia, Gary M. Lampman, George S. Kriz, James A. Vyvyan
- Macroscale and Microscale Organic Experiments, Kenneth L. Williamson, Katherine M. Masters
- Kinetic Investigation of Gas Phase Reactions Relevant to the Formation and ..., Binod Raj Giri
Vidu ankaŭ
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.




