| Hipobromita acido | ||||
 | ||||
 | ||||
| Alternativa(j) nomo(j) | ||||
Hidrogena hipobromito
| ||||
| Kemia formulo | HBrO | |||
| CAS-numero-kodo | 13517-11-8 | |||
| ChemSpider kodo | 75379 | |||
| PubChem-kodo | 83547 | |||
| Fizikaj proprecoj | ||||
| Molmaso | 96.911 g mol−1 | |||
| Smiles | OBr | |||
| Acideco (pKa) | 8.7 | |||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝo | |||
| GHS Deklaroj pri damaĝoj | H272, H312, H314, H315, H317, H318, H319, H320, H400 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P220, P221, P260, P262, P264, P273, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P337+313, P353, P360, P363, P370+378, P391, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
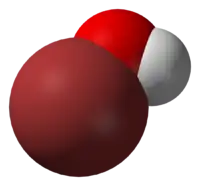
Hipobromita acido aŭ HBrO estas malforta, malstabila acido, ankaŭ konata kiel bromanolo kaj bromohidroksido. Ĝi okazas en akvaj solvaĵoj kaj posedas kemiajn kaj fizikajn proprecojn tre similaj al tiuj de hipoklorita acido.
En akvaj solvaĵoj, hipobromita acido parte dissociiĝas en anjono OBr− kaj la kationo H+. Samkiel la acido, la saloj hipobromitoj estas malstabilaj kaj kiam vaporigita aŭ bolita ĝis sekeco, ili suferas misproporcian reakcion, estigante la respektivan "bromatojn" kaj la bromidajn salojn.
Ĝeneralaĵoj
Kiam pura bromo aldoniĝas en akvon, ĝi estigas hipobromitan acidon kaj hipobromitan acidon (HBr):
Br2 + H2O ![]() HOBraq + HBraq
HOBraq + HBraq
Por dislokigi la ekvilibron dekstren, oni uzas eksceson de Hidrarga oksido (HgO), por estigi hipobromidon de hidrogeno:
Hipobromita acido dissociiĝas en akva solvaĵo laŭ la jena reakcio:
HOBraq ![]() OBr−aq + H+aq K=2.06 x 10−9at 25 °C
OBr−aq + H+aq K=2.06 x 10−9at 25 °C
HOBr uzatas kiel blankigilo, oksidanto, senodorigilo, kaj seninfektigilo, pro ĝia kapableco mortigi la ĉelojn de multaj patogenoj. La kombinaĵo estas generita en varmsangaj vertebrorganismoj, ĉefe en la eozinofiloj, kiuj produktas ĝin per agado de la "eozinofila peroksidazo", iu enzimo kiu prefere uzas bromidojn. Bromidoj ankaŭ uzatas en varmaj banujoj kaj "maldikigaj stacioj " kiel ĝermocida agento, uzante la agon de oksidiga agento por generi hipobromiton laŭ simila maniero al la peroksidazo en eozinofiloj. Ĝi estas aparte efika kiam uzatas en kombinado kun substancoj prezentaj samajn strukturojn aŭ familion.
Reakcioj
Hipobromita acido formiĝas per reakcio inter la "natria bromido" kaj la hipoklorita acido, rezultante produktadon de aktiva biocido kaj la maldanĝera natria klorido kiel flanka substanco, laŭ la reakcio[1]:
NaBraq + HOCL → NaCl + HOBr
Historio
En 1826, Antoine-Jérôme Balard (1802-1876), en siaj originalaj memoraĵoj pri la malkovro de la bromo, publikigis ke kiam la bromakvo estas miksata kun alkaloj kaj teralkaloj, per dissolvado aŭ suspensiaĵoj, la odoro kaj la koloro de la bromo malaperas, oksigeno ne eliĝas, kaj se oni aldonas malfortan acidon al la solvaĵo, la bromo liberiĝas. Laŭ Balard, la bromo estigas, per ĉi-tiuj oksidoj, analogan kombinaĵon al la tiam nomataj kloridoj de kalcio aŭ natrio.
Multaj aliaj kemiistoj, ĉefe Carl Jacob Löwig (1803-1890), Carl Julius Fritzsche (1740-1793) kaj Gay-Lussac (1778-1850), menciis la preparmanieron de la blankiga salo el bromo kun la alkaloj, akuzante la ekzistadon de la hipobromita acido. Verdire, Gay-Lussac aseris ke ĉi tiu oksido estas preparebla en la gasa stato per ago de la bromo kun seka hidrarga oksido, tamen, Teofilo Julio Peluzo (1807-1867) montris ke la gaso tiam produktita estis oksigeno. Tamen, nia kono rilate la proprecojn de ĉi tiu bromoksido estas tre limigita, tiom ke Jöns Jakob Berzelius (1779-1848) iam asertis ke ĝia ekzistado estis necerta.
Löwig plenumis plurajn esplorojn pri marĉakvoj riĉaj en magnezia bromido. Poste eliminado de la kloro, li injektis klorgason en la solvaĵon. Dum tiu procezo, nova substanco elmergiĝis: bromo. Löwig izolis la bromon per ekstraktado kun etero kaj sekva distiliĝo. Tamen, la franca kemiisto Balard, malkovris la bromon en ekstraktaĵo de maralgoj el kiu li forigis la kloron. Balard disvolvis industriajn metodojn por izolo de pluraj saloj el maralgoj.
Literaturo
- ChEBI
- Nist National Institute of Standards and Technology
- Springer Link
- ChemEd DL Arkivigite je 2015-06-29 per la retarkivo Wayback Machine
- Universitato de Majenco Arkivigite je 2016-03-04 per la retarkivo Wayback Machine
- Chem Sink Arkivigite je 2015-06-28 per la retarkivo Wayback Machine
- Publishing
- Alpha Chemical Arkivigite je 2015-06-27 per la retarkivo Wayback Machine
- Technische Universität Kaiserslautern Arkivigite je 2015-06-27 per la retarkivo Wayback Machine
- Produktado de dubromotirozino per hipobromita acido
- Publishing
- TaylorTechnologies
- Electrophilic Halogenation: Reaction Pathways Involving Attack by ..., Peter Bernard David De la Mare
- Works of the Cavendish Society: Gmelin, Leopold. Hand-book of ..., Volume 3, Cavendish Society, London
- Acid-Dissociation Constant (Ka)
Mineralaj acidoj
| Halogenidaj acidoj | |||||||
| HF | Fluorida acido | HCl | Klorida acido | HBr | Bromida acido | HI | Jodida acido |
| HFO | Hipofluorita acido | HClO | Hipoklorita acido | HBrO | Hipobromita acido | HIO | Hipojodita acido |
| HFO2 | Fluorita acido | HClO2 | Klorita acido | HBrO2 | Bromita acido | HIO2 | Jodita acido |
| HFO3 | Fluorata acido | HClO3 | Klorata acido | HBrO3 | Bromata acido | HIO3 | Jodata acido |
| HFO4 | Perfluorata acido | HClO4 | Perklorata acido | HbrO4 | Perbromata acido | HIO4 | Perjodata acido |
Vidu ankaŭ
Bromoformo 
Dubromotirozino 
Kvarbromoetano 
Karbona Kvarklorido 
n-bromo
sukcenimido











