| Furano | ||||
.svg.png.webp) | ||||
| Plataj kemiaj strukturoj de la Furano | ||||
 | ||||
| Tridimensiaj strukturoj de la Furano | ||||
| Alternativa(j) nomo(j) | ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 110-00-9 | |||
| ChemSpider kodo | 7738 | |||
| PubChem-kodo | 8029 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora volatila likvaĵo | |||
| Molmaso | 68.08 g mol-1 | |||
| Denseco | 0.936 g/cm3 | |||
| Fandopunkto | −85.6 °C (−122.1 ℉; 187.6 K) | |||
| Bolpunkto | 31.3 °C (88.3 ℉; 304.4 K) | |||
| Ekflama temperaturo | −69 °C (−92 ℉; 204 K) | |||
| Refrakta indico | 1,421 | |||
| Solvebleco | Akvo:10 g/l a 25 °C | |||
| Sekurecaj Indikoj | ||||
| Risko | R12 R19 R20/22 R26/27/28R38 R45 R48/22 R52/53 R68 | |||
| Sekureco | S45 S53 S61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[1] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H224, H302, H332, H315, H341, H350, H373, H412 | |||
| GHS Deklaroj pri antaŭgardoj | P201, P210, P273, P281, P308+313 | |||
(25 °C kaj 100 kPa) | ||||
Furano estas klaso da organikaj aromataj heterociklaj kombinaĵoj kies karakterizaĵo estas ringa strukturo komponita de unu oksigenatomo kaj kvar karbonatomoj. Ĝi estas la plej simpla membro el la familio kaj fizike ĝi estas senkolara volatila bruligebla kaj iom toksa likvaĵo kiu bolas je 31.36 °C je meditemperaturo. Ĝi estas solvebla en la plimulto de la organikaj solvantoj inklude de alkoholo, etero kaj ketonoj kaj iomete solvebla en akvo.
Proprecoj
Pro ĝia ioma tokseco ĝi povas estis karcinomiga al homoj, laŭ la Internacia Agentejo por Esploroj pri Kancero (IARC)[2]. Kutime ĝi konvertiĝas al kvarhidrofurano pere de hidrogenigo, kiu siavice uzatas kiel solvanto kaj en la produktado de adipata acido kaj heksametilenoduamino, ambaŭ krudaj materialoj por la estigo de la nilono-6,6.
Furano uzatas kiel deirpunkto kaj kruda materialo por aliaj kemiaj specialaĵoj. La furfuralo, kiu estas aldehida derivaĵo de la furano estis produktita nur en 1832 far Johann Wolfgang Döbereiner — dum preparado de la formiata acido ekde sukero kaj mangana duoksido — sed en industria skalo nur en 1930 far Quaker Oats Company kaj ĝia filio Miner Laboratory.
La furano ĝustadire estiĝis multe pli malfrue far Heinric Limpricht ĉirkaŭ 1870 per hejtado de la baria furoato kaj "soda kalko", iu miksaĵo de kalcia hidroksido, natria hidroksido, kalia hidroksido kaj akvo. La tiofeno iu derivaĵo de la furano, kie la oksigenatomo estis anstataŭita de unu sulfuratomo estis malkvrita de Victor Meyer, en 1882.[3]
| Familio de la Furano | ||||||||
 |  | 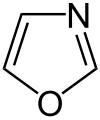 |  |  | 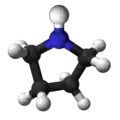 | 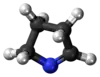 |  | |
| Kvarhidrofurano | ||||||||
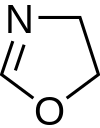 |  | 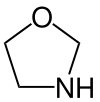 | 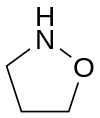 |  | 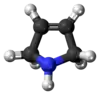 |  |  | |
| Oksazolidino | ||||||||
Reakcioj
Reakcio 1
- Produktado de la "pirolo" per amoniakigo de la "furano":[4]
|
|
Reakcio 2
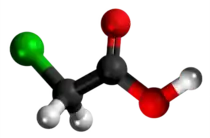
- Preparado de 2-furanoacetata acido per traktado de kloroacetata acido kun furano:
|
|
Reakcio 3
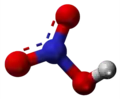
- Preparado de 2-nitrofurano per interagado de nitrata acido kun furano en ĉeesto de acetata anhidrido:
|
|
Reakcio 4
- Preparado de furanosulfonata acido per traktado de sulfura trioksido kun furano:
|
|
Historio
La termino "furano" originas de la latina lingvo furfur, kiu signifas branon.[5]
Ĝustadire la kemio de la furano komencis kun la malkovro de furanhavantaj komponaĵoj, kiel cerealoj. Kvankam la aromata furanringa sistemo ne trovatas en la besta organismo, ĝi okazas en sekundaraj plantaj metabolitoj ĉefe en terpenoidoj. La furano 2-karboksilata acido aŭ 2-furoata acido estis unue estigita de Carl Wilhelm Scheele, en 1780, ekde seka distilado el la mucika acido.
La furano estas manufakturita per gazfaza malkarbonigo de la furfuralo, kiu siavice estiĝas per agado de la sama acido sur vegetalaj restaĵoj. En 1840, John Stenhouse (1809-1880) malkovris, ke la furfuralo estiĝas pere de reakcio inter la sulfata acido kaj vasta gamo da plantaj materialoj tia kia pajla lignero.
Li ankaŭ konstatis ĝian tendencon al rezinformado. Dodd kaj Stillman (1944) malkovris, ke la furanaj derivaĵoj prezentas kontraŭbakteriajn proprecojn pro la ĉeesto de la nitrogena grupo en la 5-a pozicio de la furoata acido.
Kunrilataj kemiaĵoj
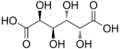
Mucika acido 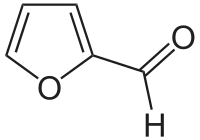



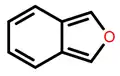
Izobenzofurano 
Nitrofurano 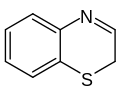
Benzotiazino
Vidu ankaŭ
Literaturo
- Organic Chemistry.org
- Sigma-Aldrich
- Organic Syntheses
- Pubs.acs.org.
- Slideshare
- Advances in Heterocyclic Chemistry, Volume 99, Alan R. Katritzky
- Heterocyclic Chemistry: Volume II: Five-Membered Heterocycles, Radha R. Gupta, Mahendra Kumar, V. Gupta
- Chemotherapy of Bacterial Infections, Volume 2,Parte 1, R. J. Schnitzer, Frank Hawking
Vidu ankaŭ
- Johann Wolfgang Döbereiner (1780-1849)
- Carl Wilhelm Scheele (1742-1786)
- John Stenhouse (1809-1880)
- Heinrich Limpricht (1827-1909)
- Thomas Anderson (1819-1874)
Referencoj
- ↑ GESTIS-Stoffdatenbank des IFA. Arkivita el la originalo je 2020-06-03. Alirita 2017-06-16.
- ↑ FDA.gov
- ↑ Topics in organic chemistry, Louis Frederick Fieser, Mary Fieser.
- ↑ Organic Chemistry
- ↑ Senning, Alexander. (2006) Elsevier's Dictionary of Chemoetymology. Elsevier. (angle)