| Fosforila bromido | |||
 | |||
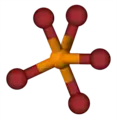
| Plata kemia strukturo de la Fosforila bromido | |||
 | |||
| Tridimensia kemia strukturo de la Fosforila bromido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 7789-59-5 | ||
| ChemSpider kodo | 23015 | ||
| PubChem-kodo | 24613 | ||
| Merck Index | 15,7460 | ||
| Fizikaj proprecoj | |||
| Aspekto | toksa, iomete oranĝokolora kaj fumeganta solidaĵo | ||
| Molmaso | 286,685 g·mol−1 | ||
| Denseco | 2,82g cm−3 | ||
| Fandpunkto | 55 °C | ||
| Bolpunkto | 191,7 °C (malkomponiĝas)[1] | ||
| Solvebleco | Akvo:reakcias | ||
| Mortiga dozo (LD50) | 380 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R14 R34 R37 | ||
| Sekureco | S7/8 S26 S36/37/39 S43 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H290, H314, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P234, P260, P261, P264, P271, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P403+233, P404, P405, P501[2] | ||
(25 °C kaj 100 kPa) | |||
Fosforila bromido aŭ POBr3 estas neorganika fosfora kombinaĵo de oksigeno kaj bromo, toksa, iomete oranĝokolora solidaĵo uzata kiel fosfora bromigagento en kemiaj sintezoj. Kiam varmigita supre de 193 °C ĝi malkomponiĝas donante ruĝecan koloron al la substanco. Ĝi estas solvebla en etero, benzeno, kloroformo, karbona dusulfido kaj koncentrita sulfata acido.[3] La substanco estas sensiva al humideco formante fumaĵojn en la aero. Ĝi eksplode reakcias kun akvo donante fosfatan acidon kaj bromidan acidon.
Sintezoj
Sintezo 1
- Preparado per traktado de fosfora kvinbromido kun fosfora kvinoksido:
|
3 |
Sintezo 2
- Preparado per traktado de fosfora tribromido kun nitrata oksido:[4]
|
|
Sintezo 3
- Fosfora tribromido reakcias kun eksceso da nitrata oksido por doni, krom fosforilan tribromidon, fosforan kvinoksidon kaj bromon:[4]
|
3 |
Reakcioj
Reakcio 1
- Ĝi reakcias kun akvo donante fosfatan acidon kaj bromidan acidon.
|
|
Reakcio 2
- Tribromido de fosforilo reakcias kun uracilo en akva medio por doni bromo-uracilon, bromidan acidon, fosfatan acidon kaj hidrogenon:
|
|
Literaturo
Vidu ankaŭ
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.