| N,N-Etilformiamido | ||
| Kemia formulo | ||
 | ||
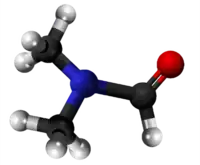
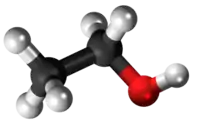
N,N-Etilformiamido | ||
 | ||
| Alternativa(j) nomo(j) | ||
| ||
| CAS-numerm-kodo | 627-45-2 | |
| ChemSpider kodo | 11815 | |
| PubChem-kodo | 12319 | |
| Fizikaj proprecoj | ||
| Aspekto | senkolora likvaĵo | |
| Molmaso | 73,095g mol−1 | |
| Denseco | 0,951 g/cm−3[1] | |
| Fandpunkto | -60°C [2] | |
| Bolpunkto | 202-204°C [3][4] | |
| Refrakta indico | 1,4327 | |
| Ekflama temperaturo | 67°C [5] | |
| Solvebleco | Akvo:solvebla | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319 | |
| GHS Deklaroj pri antaŭgardoj | P264, P264+265, P280, P302+352, P305+351+338, P321, P332+317, P337+317, P362+364 | |
(25 °C kaj 100 kPa) | ||
Etilformiamido aŭ N,N-Etilformilamido estas organika kombinaĵo kaj sekundara amino, konsistanta je etila grupo kaj formila grupo ligitaj al nitrogenatomo. Etilformiamido estas senkolora likvaĵo, solvebla en akvo, uzata en kemiaj sintezoj kun fungicidaj proprecoj. Formiligaj komponaĵoj estas gravaj peraĵoj en la sintezoj de drogoj, insekticidoj, pesticidoj, pigmentoj kaj parfumoj. Etilformiamido ankaŭ estas antaŭaĵo en la produktado de la etila izocianato. Per senkarboniligo (-CO) etilformiamidoj iĝas en etilaminojn kaj karbonan unuoksidon.
| Strukturaj izomeroj | ||
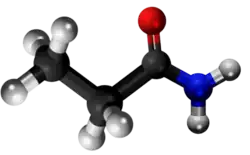
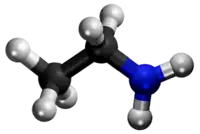
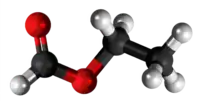
| Ili estas izomeroj (kemia formulo:C3H7NO) sed malsimilas en la distribuado de la funkciaj grupoj: en la unua kombinaĵo du metilaj grupoj kaj unu karboksila grupo ligiĝas al la nitrogenatomo; en la dua la nitrogenatomo ligiĝas al unu grupo etila kaj al alia grupo formiila kaj en la propanamido la nitrogenatomo ligiĝas al unu propanoila grupo. Oni ne menciu la hidrogenatomojn. | ||
Reakcioj
Reakcio 1
- Preparado de etilformiamido per traktado de etila formiato kun etilamino:
|
|
Reakcio 2
- Preparado de etilformiamido per traktado de etilamino kun formiila klorido:
|
|
Reakcio 3
- Preparado de etilformiamido per traktado de N-kloroetilamino kun formaldehido:
|
|
Reakcio 4
- Preparado de etilformiamido per traktado de kloroetano kun formiamido:
|
|
Vidu ankaŭ
Referencoj
- ↑ Chemical Book
- ↑ Chemsrc
- ↑ Guidechem
- ↑ Sigma Aldrich
- ↑ Molbase. Arkivita el la originalo je 2022-05-11. Alirita 2022-05-11.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.