| Ne konfuzu ĉi tiun artikolon kun Etanamido. |
| Etilamino | ||||
 | ||||
| Plata kemia strukturo de la Etilamino | ||||
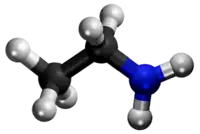 | ||||
| Tridimensia kemia strukturo de la Etilamino | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 75-04-7 | |||
| ChemSpider kodo | 6101 | |||
| PubChem-kodo | 6341 | |||
| Merck Index | 15,3817 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora gaso kun fiŝodoro | |||
| Molmaso | 45.085 g·mol−1 | |||
| Denseco | 0.689g cm−3 | |||
| Fandpunkto | −81 °C | |||
| Bolpunkto | 16.6 °C | |||
| Refrakta indico | 1,3850 | |||
| Ekflama temperaturo | −23 °C | |||
| Memsparka temperaturo | 375 °C | |||
| Acideco (pKa) | 10.98 | |||
| Solvebleco | Akvo:Tute solvebla | |||
| Mortiga dozo (LD50) | 540 mg/kg (buŝe) | |||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝo | |||
| GHS Deklaroj pri damaĝoj | H220, H280, H302, H311, H314, H318, H333, H335, H372, H373, H402[1] | |||
| GHS Deklaroj pri antaŭgardoj | P210, P260, P261, P264, P270, P271, P273, P280, P301+312, P301+330+331, P302+352, P303+361+353, P304+312, P304+340, P305+351+338, P310, P312, P314, P321, P330, P361, P363, P377, P381, P403, P403+233, P405, P410+403, P501 | |||
(25 °C kaj 100 kPa) | ||||
Etilamino estas estas primara organika amino konsistante je unu etila grupo (-CH2-CH3) ligita al alia amina grupo (NH2). Ĝi estas senkolora brulema gaso kun forta fiŝodoro solvebla en akvo, etanolo kaj etero. Etilamino estas vaste uzata en kemia industrio kaj organikaj sintezoj.
Ĝi estas neakordigebla kun oksidigagentoj, alkalaj metaloj, teralkalaj metaloj kaj multaj reakciemaj organikaj kaj neorganikaj komponaĵoj. Ĝi reakcias aŭ dissolvas multajn tipojn de farboj, plastaĵoj kaj kaŭĉukoj.
Sintezoj
Sintezo 1
|
|
Sintezo 2
- Duetilamino estas preparebla per interagado de la etilamino kaj etanolo
|
|
Sintezo 3
- Trietilamino estas preparebla per interagado de la duetilamino kaj etanolo
|
|
Sintezo 4
- Etilamino estas preparebla per kataliza interagado de la etila jodido kaj amoniako
|
|
Sintezo 5
- Alia metodo prepari etilaminon konsistas en la redukta aminigo de la acetaldehido:
|
|
Sintezo 6
- Alia metodo pli altkosta prepari etilaminon konsistas en la interagado de la etileno kaj amoniako en ĉeesto de sodamido:
|
|
Sintezo 7
- Kloroetano reakcias kun amoniako en ĉeesto de kalia hidroksido por doni etilaminon, kalian kloridon kaj akvon:
|
|
Sintezo 8
- Nitroetano reakcias kun hidrogeno en ĉeesto de stana/klorida acido por doni etilaminon kaj akvon:[2]
|
|
Sintezo 9
- La aminoacido L-teanino hidroliziĝas sub alkalaj kondiĉoj estigante glutamatan acidon kaj etilaminon:[3]
Reakcioj
Reakcio 1
- Konvertado al etilamonia nitrato:
|
|
Reakcio 2
- Konvertado al etileno:
|
|
Reakcio 3
- Konvertado al etilamonia klorido:
|
|
Reakcio 4
- Konvertado al kloroetano:
|
|
Reakcio 5
- Konvertado al etanolo:
|
|
Literaturo
- Chemical book
- Merck Millipore
- Handbook of Environmental Fate and Exposure Data For Organic Chemicals, Volume 2, Philip H. Howard
- Cellulose, Krassig
- Cambridge International AS and A Level Chemistry Coursebook with CD-ROM Lawrie Ryan, Roger Norris
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances, Pradyot Patnaik
Vidu ankaŭ
Referencoj
- ↑ Pubchem
- ↑ Conceptual Chemistry Volume-I For Class XII, S.K. Jain & Shailesh K. Jain
- ↑ Tea and Tea Products: Chemistry and Health-Promoting Properties, Chi-Tang Ho, Jen-Kun Lin, Fereidoon Shahidi
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.


