| Etila klorometanato | ||||||
 | ||||||
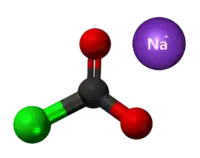
| Plata kemia strukturo de la Etila kloroformiato | ||||||
 | ||||||
| Tridimensia kemia strukturo de la Etila kloroformiato | ||||||
| Alternativa(j) nomo(j) | ||||||
| ||||||
| Kemia formulo | ||||||
| CAS-numero-kodo | 541-41-3 | |||||
| ChemSpider kodo | 10465 | |||||
| PubChem-kodo | 10928 | |||||
| Merck Index | 15,3839 | |||||
| Fizikaj proprecoj | ||||||
| Aspekto | senkolora likvaĵo | |||||
| Molmaso | 108.521 g·mol−1 | |||||
| Denseco | 1.1403g cm−3 | |||||
| Fandpunkto | −81 °C | |||||
| Bolpunkto | 95 °C | |||||
| Refrakta indico | 1,3974 | |||||
| Ekflama temperaturo | 16 °C | |||||
| Memsparka temperaturo | 450 °C | |||||
| Acideco (pKa) | 8.35 | |||||
| Mortiga dozo (LD50) | 204 mg/kg (buŝe) | |||||
| GHS etikedigo de kemiaĵoj | ||||||
| GHS Damaĝo-piktogramo |
| |||||
| GHS Signalvorto | Damaĝo | |||||
| GHS Deklaroj pri damaĝoj | H225, H226, H290, H301, H302, H314, H318, H330, H400[1] | |||||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P234, P240, P241, P242, P243, P260, P264, P270, P271, P273, P280, P284, P301+310, P301+312, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P330, P363, P370+378, P391, P403+233, P403+235, P404 | |||||
(25 °C kaj 100 kPa) | ||||||
Etila kloroformiato estas etila estero de la kloroformiata acido, senkolora, brulema kaj koroda likvaĵo preparata per interagado de la fosgeno kaj etanolo. Ĝi posedas fortan odoron simile al klorida acido kaj malkomponiĝas en akva solvaĵo.
Ĝi estas miksebla kun alkoholo, benzeno, kloroformo kaj etero. La vaporoj de etil-kloroformiato estas forte iritaj al okuloj, mukozaj membranoj kaj haŭto. Ĝi kaŭzas iriton al la supera spirsistemo akompanata de tuso, dispneo, pulmedemo, larmigo, naŭzo, vomado, stomako-doloro, malforteco krom aliaj simptomoj.
Etila kloroformiato agas kiel vaste uzata peranto en la produktado de karbonatoj kaj karbamatoj, kiuj cetere estas materialoj uzataj en sintezoj en farmaciaj industrioj.
Sintezoj
Sintezo 1
- Preparado per agado de kloroformiata acido kaj etila alkoholo:
|
|
Sintezo 2
- Preparado per traktado de kloroformiata anhidrido kaj etila alkoholo:
|
|
Sintezo 3
- Preparado per reakcio de kloroformiata acido kaj etila klorido:
|
|
Sintezo 4
- Preparado per interagado de natria kloroformiato kaj etila klorido:
|
|
Sintezo 5
- Preparado per interagado de fenetila kloroformiato kaj etila formiato:
|
|
Sintezo 6
- Preparado per acida transesterigo inter kloroformiata acido kaj etila salikato:
|
|
Sintezo 7
- Preparado per alkohola transesterigo inter benzila kloroformiato kaj etila alkoholo:
|
|
Sintezo 8
- Etila kloroformiato estas preparata per agado de la etanolo sur fosgeno:
|
|
Reakcioj
Reakcio 1
- Hidrolizo de la etila kloroformiato:
|
|
Reakcio 2
- Sapigo de la etila kloroformiato:
|
|
Reakcio 3
- Reakcio per acida transesterigo kun formiata acido:
|
|
Reakcio 4
- Reakcio per alkohola transesterigo kun etila alkoholo:
|
|
Reakcio 5
- Reduktigo de la etila kloroformiato:
|
|
Reakcio 6
- Reakcio kun NH3:
|
|
Reakcio 7
- Reakcio kun HCl:
|
|
Literaturo
- Wiley Guide to Chemical Incompatibilities, Richard P. Pohanish, Stanley A. Greene
- Ester Formation and Hydrolysis and Related Reactions, R.G. Compton, C.H. Bamford, C.F.H. Tipper†
- Purification of Laboratory Chemicals, W.L.F. Armarego, Christina Chai
- CRC Handbook of Chromatography: Analysis of Lipids, Kumar D. Mukherjee, Nikolaus Weber
- Phase Transfer Catalysis: Principles and Techniques, Charles Liotta
- Hamilton and Hardy's Industrial Toxicology, Raymond D. Harbison, Marie M. Bourgeois, Giffe T. Johnson
Vidu ankaŭ
Referencoj
| ||||||
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.