| Dumetila sulfato | |||||
 | |||||
| Plata kemia strukturo de la Dumetila sulfato | |||||
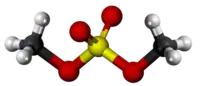 | |||||
| Tridimensia kemia strukturo de la Dumetila sulfato | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
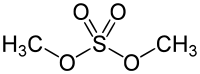
| Kemia formulo | |||||
| CAS-numero-kodo | 77-78-1 | ||||
| ChemSpider kodo | 6252 | ||||
| PubChem-kodo | 6497 | ||||
| Merck Index | 15,3280 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora, oleeca, koroda, senodora, toksa, brulema likvaĵo | ||||
| Molmaso | 126,126 g·mol−1 | ||||
| Denseco | 1,3322g cm−3 | ||||
| Fandpunkto | −27 °C | ||||
| Bolpunkto | 188 °C[1] | ||||
| Refrakta indico | 83 | ||||
| Solvebleco | Akvo:28 g/L | ||||
| Mortiga dozo (LD50) | 440 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R45 R25 R26 R34 R43 R68 | ||||
| Sekureco | S53 S45 S30 S60 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H301, H310, H314, H317, H319, H330, H335, H341, H350 | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P260, P261, P262, P264, P270, P271, P272, P280, P281, P284, P301+310, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P308+313, P310, P320, P321, P330, P333+313, P337+313, P361, P363, P403+233, P405, P501[2] | ||||
(25 °C kaj 100 kPa) | |||||
Dumetila sulfato aŭ prefereble dimetila sulfato[3] (formulo C2H6O4S) estas organika komponaĵo apartenanta al la funkcia grupo estero, senkolora, oleeca, koroda, senodora, toksa, brulema likvaĵo, uzata en kemiaj sintezoj, en la produktado de pesticidoj, insekticidoj kaj kiel laboratoria reakciaĵo.
Sulfato de dumetilo estis unue raportita en 1913 far la anglaj kemiistoj C. S. Reeve kaj R. H. Lewis.[4] dum esplorado de petrolaj derivaĵoj. Kiel ĉiuj alkiligagentoj, dumetila sulfato estas treege toksa kaj per inhalado kaj per ingestado. Ĝi estas karcinomogena kaj irita al okuloj kaj haŭto.
Sintezoj
Sintezo 1
- Preparado per reakcio inter metila nitrito kaj klorosulfonata acido
|
2 |
Sintezo 2
- Preparado per traktado de metanolo sur sulfata acido:
|
|
Sintezo 3
- Preparado per interagado de natria sulfato kaj metanolo en ĉeesto de sulfata acido [5]
|
|
Sintezo 4
- Preparado per interagado de klorosulfonata acido kaj metanolo:
|
2 |
Sintezo 5
- Preparado per reakcio inter kalcia sulfato kaj metanolo:
|
|
Sintezo 6
- Per termolizo de metila-bisulfato:
|
2 |
Sintezo 7
- Preparado per traktado de trimetila fosfato kaj sulfata acido:
|
2 |
Sintezo 8
- Preparado per traktado de trimetila orto-acetato kaj sulfata acido:
|
2 |
Sintezo 9
- Preparado per traktado de trimetila arsino kaj sulfata acido:
|
2 |
Reakcioj
Reakcio 1
- Preparado de klorometano:
|
|
Reakcio 2
- Reakcio kun natria hidroksido:[6]
|
|
Reakcio 3
- Hidrolizo de dumetila sulfato:
|
|
Reakcio 4
- Preparado de dumetila karbonato:
|
|
Reakcio 5
- Preparado de 4-metil-fenolo:
|
|
Reakcio 6
- Preparado de trimetilamino:
|
|
Reakcio 7
- Reakcio inter dumetila sulfato kaj natria hidroksido:
|
2 |
Reakcio 8
- Preparado de metila metanosulfonato:
|
|
Reakcio 9
- Preparado de bromometano:
|
|
Reakcio 10
- Reakcio kun nitrogena duoksido:
|
|
Literaturo
Referencoj
- ↑ Chemical Book
- ↑ PubChem
- ↑ Zdeněk Pluhař (2011). SISTEMA ĤEMIA NOMENKLATURO EN ESPERANTO, p. 26. Arkivita el la originalo je 2015-07-06. Alirita 2020-02-26.
- ↑ Journal of the Society of Chemical Industry
- ↑ Erowid
- ↑ Pollution Prevention and Waste Minimization in Laboratories
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.