| Dukloramino | |||||
 | |||||
| Plata kemia strukturo de la Dukloramino | |||||
 | |||||
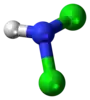
| Tridimensia kemia strukturo de la Dukloramino | |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 3400-09-7 | ||||
| ChemSpider kodo | 69389 | ||||
| PubChem-kodo | 76939 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | flava, koroda, toksa gaso kun biocidaj proprecoj | ||||
| Molmaso | 85,915 g·mol-1 | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R19 R27/28 R45 | ||||
| Sekureco | S7 S22 S26 S36 S37 S39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H290, H314, H315, H319, H335, H372, H412 | ||||
| GHS Deklaroj pri antaŭgardoj | P234, P260, P261, P264, P270, P271, P273, P280, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P310, P314, P321, P332+313, P337+313, P362, P363, P403+233, P404, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Dukloramino aŭ NHCl2 estas estas reakciema neorganika komponaĵo de kloro kaj nitrogeno, flava, koroda, eksploda, toksa gaso kun biocidaj proprecoj kaj malstabila konduto en akvaj solvaĵoj. Ĝi uzatas kiel kemia reakcianto kaj en traktado de trinkakvo. Sub media temperaturo ĝi povas eksplode malkomponiĝi formante amoniakon, hidrazinon kaj hidrogenon. Per hidrozilo ĝi formas hipojoditan acidon kaj amoniakon. Kune kun kloramino kaj trikloramino ĝi formas la tri ĉefajn neorganikajn aduktojn de kloro kaj amoniako.[1] Dukloramino posedas antimikrobiajn kaj karcinomogenajn proprecojn.
Sintezoj
Sintezo 1
- Preparado per interagado de amoniako kaj duklora oksido:
|
|
Sintezo 2
- Preparado per traktado de kloramino kaj klorida acido
|
|
Sintezo 3
- Preparado per reakcio de amonia nitrito kun kloro
|
|
Sintezo 4
- Preparado per traktado de kloramino kaj trikloramino:
|
|
Sintezo 5
- Preparado per interagado de kloramino kaj hipoklorita acido:
|
2 |
Reakcioj
Reakcio 1
- Eksploda malkomponado de dukloramino:[2]
|
6 |
Reakcio 3
- Hidrolizo de de dukloramino:
|
|
Reakcio 4
- Dukloramino transformas sulfitojn en sulfatojn en akva medio:
|
|
Reakcio 5
- Dukloramino transformas pirosulfitojn en bisulfatojn:
|
|
Reakcio 6
- Dukloramino transformas jodidojn en hipojoditojn:
|
|
Reakcio 7
- Dukloramino liberigas jodon de jodidoj en acida medio:[3]
|
|
Vidu ankaŭ
Literaturo
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.