| Duetila dusulfido | ||||
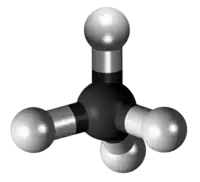
| Plata kemia strukturo de la Duetila dusulfido | ||||
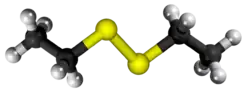 | ||||
| Tridimensia kemia strukturo de la Duetila dusulfido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 110-81-6 | |||
| ChemSpider kodo | 7786 | |||
| PubChem-kodo | 8077 | |||
| Fizikaj proprecoj | ||||
| Aspekto | Brulema, senkolora aŭ flaveca likvaĵo kun ajlosimila odoro | |||
| Molmaso | 122,244 g·mol−1 | |||
| Denseco | 0,995g cm−3[1] | |||
| Fandpunkto | −102 °C[2] | |||
| Bolpunkto | 152 °C | |||
| Refrakta indico | 1,5060 | |||
| Ekflama temperaturo | 40 °C[3] | |||
| Memsparka temperaturo | 189 °C[4] | |||
| Solvebleco | Akvo:reakcias | |||
| Mortiga dozo (LD50) | 2030 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R11 R20 R22 R36 R37 R43 R50 R53 | |||
| Sekureco | S16 S24 S26 S37 S61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Averto | |||
| GHS Deklaroj pri damaĝoj | H226, H315, H319, H335 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P261, P264, P271, P280, P302+352, P303+361+353, P304+340, P305+351+338, P321, P332+313, P337+313, P362, P370+378, P403+233, P403+235, P405, P501[5] | |||
(25 °C kaj 100 kPa) | ||||
Duetila dusulfido aŭ C4H10S2 estas kemia organika sulfura kombinaĵo, brulema, senkolora aŭ flaveca likvaĵo kun ajlosimila odoro, vaste uzata en sennombraj organikaj sintezoj, kiel solvanto por anhidraj mineraloj kaj en oraj kaj arĝentaj tegmentobanoj. Duetila dusulfido estas pli densa ol aero, malpli densa ol akvo, kaj ĝiaj vaporoj estas iritaj al okuloj kaj haŭto.
Sintezoj
Sintezo 1
- Preparado per interagado de tioetanolo kaj jodo:
|
2 |
Reakcioj
Reakcio 1
- Pirolizo de dumetila dusulfido:[6]
|
2 |
Reakcio 2
- Reakcio de dumetil-sulfido kaj hidrogena peroksido:
|
|
Reakcio 3
- Preparado de etano-sulfinila klorido:
|
|
Reakcio 4
- Preparado de etano-sulfonila klorido:
|
|
Literaturo
Referencoj
- ↑ Chemicalland21
- ↑ Alfa Aesar
- ↑ Fisher Scientific. Arkivita el la originalo je 2018-12-28. Alirita 2018-12-28.
- ↑ Chevron Phillips Chemical Company. Arkivita el la originalo je 2018-12-28. Alirita 2018-12-28.
- ↑ PubChem
- ↑ Decomposition and Isomerization of Organic Compounds
| ||||||
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.