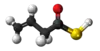| Dualila dusulfido | |||
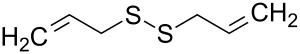 | |||
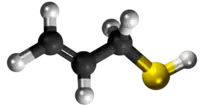
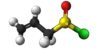
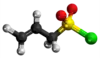
| Plata kemia strukturo de la Dualila dusulfido | |||
 | |||
| Tridimensia kemia strukturo de la Dualila dusulfido | |||
 | |||
| Dualila dusulfido nature trovata en la ajlo | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 2179-57-9 | ||
| ChemSpider kodo | 15730 | ||
| PubChem-kodo | 16590 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora aŭ likvaĵo kun penetranta sulfura odoro | ||
| Molmaso | 146,266 g·mol−1 | ||
| Denseco | 1,008g cm−3[1] | ||
| Bolpunkto | 185 °C[2] | ||
| Refrakta indico | 1,537[3] | ||
| Ekflama temperaturo | 42,4 °C | ||
| Solvebleco | Akvo:<0,1 g/L | ||
| Sekurecaj Indikoj | |||
| Riskoj | R10 R22 R36/37/38 [4] | ||
| Sekureco | S16 S26 S37/39 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H226, H301, H315, H317, H319 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P261, P264, P270, P272, P280, P301+310, P302+352, P303+361+353, P305+351+338, P321, P330, P332+313, P333+313, P337+313, P362, P363, P370+378, P403+235, P405, P501[5] | ||
(25 °C kaj 100 kPa) | |||
Dualila dusulfido aŭ C6H10S2 estas kemia kombinaĵo, apartenanta al la funkcia grupo de la dusulfidoj el la dusulfida acido kaj alila alkoholo. Dualila dusulfido estas senkolora aŭ likvaĵo kun penetranta sulfura odoro, analiza reakciaĵo uzata en kemiaj sintezoj kaj en la fabrikado de kosmetikaĵoj kaj farmaciaĵoj. Kutime ĝi estiĝas per kondensiĝa reakcio aŭ per esterigo de Fischer-Speyer kun sulfata acido kiel katalizilo. Dualila dusulfido estas malmulte solvebla en akvo, sed tute solvebla en alkoholo, duetila etero, kloroformo kaj plejmulto el la organikaj solvantoj. Dualila dusulfido reakcias kun fortaj oksidigagentoj kaj fortaj bazoj. Dusulfidaj esteroj malkomponiĝas per varmigo aŭ kun la tempopaso en sulfuro aŭ sulfuraj derivaĵoj.
Sintezoj
Sintezo 1
- Preparado per agado de jodo kaj tioalila alkoholo:
|
|
Sintezo 2
- Preparado per traktado de bromo kaj tioalila alkoholo:
|
|
Sintezo 3
- Preparado per interagado de tioalila alkoholo kaj sulfura dubromido'':[6]
|
|
Sintezo 4
- Preparado per interagado de tioalila alkoholo kaj sulfura duklorido:
|
|
Sintezo 5
- Preparado per interagado de dusulfura dujodido kaj [[butano:
|
|
Sintezo 6
- Preparado per acida transesterigo inter dusulfura dubromido kaj butano:
|
|
Sintezo 7
- Preparado per interagado de natria dusulfido kaj alila klorido:
|
|
Reakcioj
Reakcio 1
- Reduktigo de la dualila dusulfido:
|
|
Reakcio 2
- Kataliza reakcio kun elementa karbona unuoksido:
|
|
Reakcio 3
- Reakcio kun hidrogena peroksido:
|
|
Reakcio 4
- Reakcio kun klora unuoksido:
|
|
Reakcio 5
- Reakcio kun klora duoksido:
|
|
Reakcio 6
- Reakcio kun klorida acido:
|
|
Reakcio 7
- Transesteriga reakcio kun fenolo:
|
|
Literaturo
- Sigma Aldrich
- The Good Scents Company
- Source Book of Flavors
- Garlic and Other Alliums: The Lore and the Science
- Essential Oil Safety - E-Book: A Guide for Health Care Professionals
- Application of Essential Oils in Food Systems
- Edible Medicinal and Non Medicinal Plants
- Herbs and Natural Supplements Inkling: An Evidence-Based Guide
Vidu ankaŭ
Referencoj
| ||||||