Oksido estas la rezulto de la kombinado de oksigeno(j) kun malpli elektronnegativa(j) elemento(j).
Preskaŭ ĉiuj metaloj formas oksidojn ĉe kontakto kun oksigeno. Pro sia agresemo, oksigeno kovras ilin per maldika tavolo de oksido. Ĉi tiu kovrilo povas havi la efikon aŭ protekti la subestan metalon kiel pri la kazo de alumino (oni tiam parolas pri pasivigado), aŭ male prezenti vundeblecon kiel en la kazo de fero.
Kelkaj gravaj oksidoj
- Molekulaj strukturoj




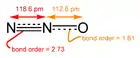

Nomenklaturo de oksidoj
Kiam estas malsamaj oksidoj por sama elemento E, prefikso estas aldonita al la vorto "oksido". Tiuj prefiksoj karakterizas la nombrojn da atomoj kaj de oksigeno kaj de la elemento E [1]:
| n x O | Prefikso |
|---|---|
| 1 | mono- |
| 2 | di- |
| 3 | tri- |
| 4 | tetra- |
| 5 | penta- |
Ekzemplo: la dinitrogena pentaoksido kun du elementoj nitrogeno kaj kvin elementoj oksigeno.
Referencoj
- ↑ Vidu en paĝo 25 de la Sistema ĥemia nomenklaturo en Esperanto (aŭtoro Zdeněk PLUHAŘ) Arkivigite je 2022-02-14 per la retarkivo Wayback Machine
Vidu ankaŭ
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
