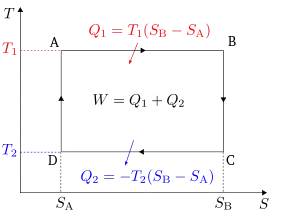
CD : izotemperatura kunpremo; DA : adiabata kunpremo; AB : izotemperatura ekspansio; BC : adiabata ekspansio.
La ciklo de Carnot [karNO] estas termodinamika ciklo, kiu konsistas el kvar termodinamikaj procezoj, du izotemperaturaj procezoj kaj du izovarmaj procezoj. Ĝi priskribas, kiel varmo-motoro transformas varmo-energion al movo-energio.
Ĝin priskribis Sadi Carnot, kiu en la jaroj 1820-aj esploris pri termodinamiko.
La ideala maŝino de Carnot konsistas el cilindro kaj piŝto, gaso en la cilindro kaj du rezervujoj, unu de alta konstata temperaturo Tc, unu alia de konstanta malalta temperaturo Ta. (La dua povas esti la "medio".) La ciklo konsistas el jenaj fazoj, kiujn trairas materio (gaso) periode varmigata kaj malvarmigata:
- Inversigebla izotemperatura kunpremo de la gaso je malalta temperaturo Ta. La gaso estas en kontakto kun la malvarma rezervujo, kiu malhelpas varmiĝon, kiun normale kaŭzus kunpremo.
- Inversigebla izovarma kunpremo. La gaso estas pli kunpremata, sen kontakto al iu varmorezervujo. Ĝi estas izolita, tiel ke neniu varmo povas en- aŭ el-iri. La gaso estas kunpremata ĝis atingo de Tc.
- Inversigebla izotemperatura dilatiĝo (ekspansio) je alta temperaturo Tc. Dum tiu fazo la ekspansianta gaso movas la piŝton, kiu kapablas pludoni sian movoenergion. Por teni la temperaturon konstanta necesas aldoni varmo-energion el la varma rezervujo.
- Inversigebla izovarma dilatiĝo. Ankaŭ por tiu fazo necesas varmo-izolo de piŝto kaj cilindro, tiel ke varmo ne povas en- aŭ el-iri tra ili. La ekspansio de la gaso produktas plian movoenergion; la gaso malvarmiĝas ĝis temperaturo Ta. La komenca stato estas atingita, la ciklo povas rekomenciĝi.
La kunpremado dum fazoj 1 kaj 2 postulas movoenergion, sed la fazoj 3 kaj 4 produktas pli da movoenergio.
La ciklo estas aplikebla ankaŭ al varmo-pumpilo, kiu laŭ la samaj principoj transformas movoenergion al temperatur-diferenco.
Formulado
La diferenco inter la eldonita laboro dum la izoterma kaj adiabata ekspansioj kaj la ricevita laboro dum la izoterma kaj adiabata kunpremoj prezentas la gajnitan laboron de la tuta ciklo. Ĉi tiu laboro egalas al la diferenco de la alkondukita varmo el la provizujo kun la temperaturo T1 kaj de la forkondukita varmo en la provizujon kun la temperaturo T2.
(86)
w0 – la laboro gajnita per la ciklo kJ/kg
q1 – la varmo aldonita dum la izoterma ekspansio kJ/kg
q2 - la varmo forprenita dum la izoterma kunpremo kJ/kg
Alkondukita varmo dum la izoterma ekspansio (A-B) estas:
- Por la premo validas la rilato el la statoekvacio:
- estas la alkondukita varmo. Ĝi estas pozitiva.
La forkondukita varmo dum la izoterma kunpremo (C-D) estas:
- estas la forkondukita varmo. Ĝi estas negativa.
Se oni pruvas, ke la proporcioj de volumenoj vB/vA = vC/vD, tiel proporcio de aldonita kaj forprenita varmoj egalas al la temperaturproporcio de la provizujoj T1/T2.
El la dependeco de stataj grandoj por la adiabata ŝanĝiĝo de la gaso validas
a) por la adiabata kunpremo:
(87)
b) por la adiabata ekspansio:
(88)
oni povas la ekvaciojn (87) kaj (88) unuigi:
aŭ ankaŭ
(89)
do
Kiam estas la proporcioj de la specifaj volumenoj egalaj, tiam estas ankaŭ iliaj naturaj logaritmoj egalaj. La ekspansia kaj kunperema adiabataj laboroj estas en siaj absolutaj valoroj egalaj, sed reciproke sinnuligantaj.
Tial restas nur la laboroj el la izotermaj procezoj, kaj la laboro de la tuta ciklo de Carnot estas:
Efikeco de ciklo de Carnot
La termodinamika efikeco de la ciklo de Carnot estas:
do
(90)
La termodinamika efikeco de la ciklo de Carnot (senenergiperdo) kun la ideala gaso dependas nur de la absolutaj temperaturoj, inter kiuj la ciklo realiĝas. Ĝi ne dependas de la materio uzita en la ciklo.
La ciklo de Carnot havas la plej grandan efikecon. Ĉiu alia ciklo realiĝanta inter la samaj du temperaturoj (de la izoterma ekspansio kaj de la izoterma kunpremo) devas havi pli malgrandan varmefikecon. tial servas la ciklo de Carnot kiel kompara ciklo:
La ekvacio (90) deduktigas:
a) La termodinamikan efikecon de la cikklo de Carnot oni povas plialtigi plialtigante la temperaturon de la varmalkonduko al la labormaterio kaj plimalatigante la temperaturon de la varmforkonduko el la labormaterio.
b) La termodinamikan efikco ne povas atingi la valoron 1, ĉar devus esti aŭ Tc = , aŭ Ta = 0 K. Sed bedaurinde oni ne povas ĉi tiujn ambaŭ kazojn praktike realigi.
Tio signifas, ke eĉ per la ciklo de Carnot, kies efikeco inter ĉiuj cikloj estas la plej alta, oni ne povas ĉiun alkondukitan varmon al la gaso ŝanĝi en laboron.
La rea ciklo de Carnot
Kiam la ciklo de Carnot realiĝas en la rea direkto (tio estas kontraŭ la cirkuldirekto de horloĝmontriloj desegnita en la p-v diagramo), tiam la ciklo bezonas aldoni la laboron w0, egalan al la diferenco de la varmoj qc – |qa|, por ŝanĝi ĝin en la varmon, kiun oni kun la varmo qa prenita el la pli malvarma provizujo transdonas al la pli varma provizujo. La tutan varmon qc = + w0 oni gajnas helpe de la aldono de la laboro w0. La efikeco de ĉi tiu ŝanĝiĝo estas:
(91)
qa – la varmo prenita el la pli malvarma provizujo por 1 kg da laborgaso, kJ/kg
qc – la varmo transdonita al la pli varma provizujo per 1 kg da laborgaso, kJ/kg
Ta – la temperaturo de la pli malvarma provizujo, °K
Tc – la temperaturo de la pli varma provizujo, °K
La efikeco de ĉi tiu varmgajnado helpe de la meĥanika laboro povas atingi sufiĉe grandan valoron. Dum ĉi tiu laborciklo okazas tiel nomata "varmtraĉerpado". La termodinamika efikeco estas ankaŭ nomita koeficiento de multobligado. Ĝi estas ĉiam pli granda ol 1.
La neinversigebla ciklo de Carnot
Inter la varmprovizujoj kaj la laborgaso devas esti iu temperaturdiferenco. Tial estos la temperaturo de la laborgaso dum ĝia ekspansio pli malata kaj dum la kunpremo pli alta ol la temperaturoj de la provizujoj Tc kaj Ta. Kiam estos la temperaturoj de ambaŭ varmprovizujoj, por kies helpo la neinversigebla ciklo realiĝas, Tc kaj Ta, ciam validas ĉi tiu rilato de la termodinamika efikeco:
(92)
Tc, Ta – la temperaturoj de ambaŭ varmprovizujoj, °K
T’c, T’a – la temperaturoj de la laborgaso, °K
q1, q2 – la aldonita kaj forprenita varmoj je la gaso, kJ/kg .
La neinversigebleco de ŝanĝiĝoj estas kaŭzita pro la temperaturdiferenco inter la gaso kaj la varmprovizujo, ĉar (T’c- T’a)<(Tc-Ta), kaj pro la frotado, kiu kaŭzas varmeldonadon. La temperaturdiferenco inter du korpoj estas bedaŭrinde la neevitebla kondiĉo de la varminterŝanĝo. La varmo transiras de la pli varma korpo al la pli malvarma korpo. Ĉi tiu kondiĉo de la varmtransiro memkompreneble kontraŭas la plenumon de la inversigeblec-kondiĉo, kiu supozas termodinamikan ekvilibrecon inter la gaso kaj ĝia ĉirkaŭaĵo.
Tial validas:
(92a)
(92)
(92b)
Eksteraj ligiloj
- (france) Movbildo pri ciklo de Carnot El retadreso univ-lemans.fr
- (france) Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance - Sadi Carnot (1796-1832) Texto de Sadi Carnot el retadreso bibnum.education.fr
Vidu ankaŭ
- Unua leĝo de termodinamiko
- Ciklo de Otto
- Ciklo de Diesel
- Ciklo de Braytona-Joule
- Ciklo de Joule
