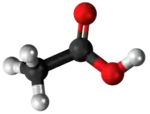
| Benzaldehido | ||
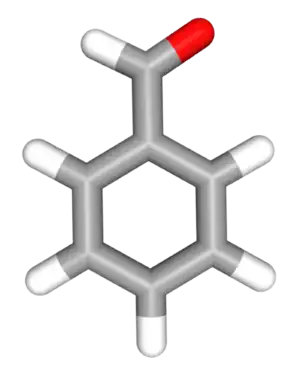 | ||
| Bastona kemia strukturo de la Benzaldehido | ||
 | ||
| Tridimensia strukturo de la Benzaldehido | ||
 | ||
| Migdalujo, arbo kiu donas amigdalinon, antaŭanton de la benzaldehido. | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | 100-52-7 | |
| ChemSpider kodo | 235 | |
| PubChem-kodo | 240 | |
| Merck Index | 15,1060 | |
| Fizikaj proprecoj | ||
| Aspekto | senkolora aŭ flaveca likvaĵo forte refrakta | |
| Molmaso | 106.12 g·mol-1 | |
| Denseco | 1.044 g cm−3 | |
| Fandpunkto | −57 °C | |
| Bolpunkto | 178.1 °C | |
| Refrakta indico | 1,5456 | |
| Ekflama temperaturo | 64 °C | |
| Memsparka temperaturo | 192 °C | |
| Solvebleco | Akvo: 3,3 g/L (20 °C)
| |
| Mortiga dozo (LD50) | 1200 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Risko | R22 | |
| Sekureco | S24 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj[1] | ||
| GHS Damaĝo-piktogramo | 07|08} | |
| GHS Signalvorto | Damaĝa substanco | |
| GHS Deklaroj pri damaĝoj | H227, H302+312, H315, H320, H317, H334, H401, H412 | |
| GHS Deklaroj pri antaŭgardoj | P210, P261, P264, P270, P272, P273, P280, P301+312, P302+352, P304+341, P305+351+338, P330, P333+313, P337+313, P342+311, P362, P370+378, P403+235, P501 | |
(25 °C kaj 100 kPa) | ||
Benzaldehido estas organika kombinaĵo konsistante je benzena ringo kaj formiila (R-COH) substituanto. Ĝi estas la plej simpla aromata aldehido kaj unu el la plej industrie utilaj substancoj. Ĉi-senkolora likvaĵo posedas karakterizan migdalecan odoron.[2][3] Benzaldehido estas la ĉefa komponaĵo en la oleo de amaraj migdaloj kaj povas ekstraktiĝi per serio da aliaj naturaj fontoj.
Sinteza benzaldehido estas odorigagento kiu imitas la migdalan ekstraktaĵon, kiu uzatas por odorigi kukojn kaj aliajn bakitaĵojn. Benzaldehido ĉeestas en la esenco de Pleurotus ostreatus. Ĉi-substanco estas iom damaĝa al okuloj kaj mukoza membrano de la spira sistemo. Pro ĝia malalta volatileco ĝiaj stimulaj efektoj ne estas sufiĉaj por kaŭzi damaĝojn.
Historio
Justus von Liebig (1803-1873) kaj Friedrich Wöhler (1800-1882), du eminentaj germanaj sciencistoj, studis la proprecojn de la amara migdaloleo kaj malkovris ke la sama grupo (benzoila aŭ C6H5CO-) senŝanĝe pasas tra varieco da reakcioj -- ĝi estas la tiam nomata "radikalo". Von Liebig kaj Wöhler estis stimulitaj de esploroj faritaj en Francio: en 1830, la kemiistoj Pierre Jean Robiquet (1780-1840) kaj Antoine Charlard (1796-1879) konvertis la oleon de amaraj migadloj en benzoata acido per oksidado.
Ili same kreis neŭtralan komponaĵon kiu malkomponiĝis al benzoata acido kaj alia kristaleca substanco kiu formis la saman acidon ekde la oleo. Ili nomis la kristalecan materialon amigdalino kaj deduktis ke la oleo estis la benzoila radikalo.
Provante sistematigi la organikan kemion, von Liebig pli malfrue disvolvis lia teorio pri la radikaloj, kiu hipoteze asertas ke organikaj komponaĵoj estas rezulto de interagoj kaj transformoj de radikaloj anstataŭ atomoj. Pli malfrue, la vorto "radikalo" estis uzata por determinado de atomo aŭ grupo da atomoj enhavante malparigitan elektronon, kaj do ĝi iĝis sinonimo de "libera radikalo", signifante "nekombinita radikalo".[4]
En 1803, D-ro Schrader, en Berlino, malkovris ke pistitaj migdaloj liberigis "prusian acidon". La unuaj kiuj detektis la glikozidon en la substanco estis la francaj kemiistoj Robiquet kaj Charlard, en 1830. En 1837, Liebig kaj Wöhler esplori la strukturon de la komponaĵo kaj malkovris ke ĝi enhavas benzaldehidon, cianidan acidon kaj sukeron.
En antikva Egiptio, semoj de persikoj estis uzataj en la ekzekutado de mortopuno. Tamen, eĉ en la hodiaŭaj tagoj, dum farado de la germana tradicia fruktohava pano konata kiel "Stollen", kelkaj amaraj migdaloj devas aldoniĝi al la pasto por proporcii la ĝustan guston. Tamen, tiaj fruktoj ne estas vendeblaj en superbazaroj, sed en farmacioj kaj en etaj kvantoj enhavante adekvatan konsilon.
Malgraŭ tio, semoj de amaraj migdaloj povas konsideriĝi specialaĵo. Cianogenaj glikozidoj estas serioza problemo en pluraj ĉiutagaj manĝaĵoj en tropikaj landoj tiaj kiaj la maniokoj, batatoj, bambuoĝermoj kaj limofazeoloj.[5]
Sintezoj
Sintezo 1
- Benzaldehido estigeblas per enzima hidrolizo de la amigdalino:
|
|
Sintezo 2
- Per interagado de la benzonitrilo kun klorida acido en ĉeesto de stana II klorido sekvata per hidratigo:
|
|
Sintezo 3
- Benzaldehido prepareblas per klorigo de la tolueno sekvata per kataliza hidratigo:
|
|
Sintezo 4
- Industrie, benzaldehido estiĝas per gasfaza oksidado de la tolueno en la ĉeesto de vanada kvinoksido kaj molibdena oksido sub 350 °C:
|
|
Sintezo 5
- Ekde la tolueno per interagado de la kromiila klorido (CrO2Cl2) en ĉeesto de karbona dusulfido aŭ karbona kvarklorido:
|
2 |
Sintezo 6
- Ĉar la cinamomoleo estas facile akirebla, benzaldehido preparatas ekde la cinamaldehido per refluo en akva/alkohola solvaĵo inter 90 °C kaj 150 °C en baza medio dum 5 ĝis 8 horoj, sekvata per distilado de la fina produkto:[6]
|
|
Sintezo 7
- Benzaldehido ankaŭ preparatas per oksidado de la benzila alkoholo kun koncentrita nitrata acido:
|
|
Sintezo 8
- Aldehida sintezo de Gattermann-Koch: Benzeno konvertiĝas en benzaldehidon pasante miksaĵon da karbona unuoksido kaj gasa klorida acido sub alta premo meze de etera solvaĵo de benzeno en ĉeesto de anhidra aluminia klorido kaj kupra (I) klorido:
|
|
Sintezo 9
- Preparado de benzaldehido per traktado de benzeno, kloroformo kaj natria hidroksido:
|
|
Sintezo 10
|
|
Sintezo 11
- Reakcio de Rosenmund[7]:Benzoila bromido povas konvertiĝi al benzaldehido per reduktigo en ĉeesto de paladio:[8][9]
|
|
Reakcioj
Reakcio 1
- La nitrobenzaldehido estiĝas per nitrogenigo de la benzaldehido en ĉeesto de sulfata acido:
|
|
Reakcio 2
- En industrio, benzaldehido uzatas ĉefe kiel antaŭanto al multaj organikaj komponaĵoj, variantaj el farmaciaĵoj kaj plastaj aldonaĵoj. La mandelata acido[10] estigeblas ekde la benzaldehido, per reakcio kun cianida acido, sekvata per hidrolizo de la mandelonitrilo:[11]
|
|
Reakcio 3
- La originala sintezo de la cinamata acido envolvas la Reakcio de Perkin, [12], kiu entenas la katalizobazan kondensiĝon de la acetata anhidrido kaj benzaldehido[13]. Ludwig Claisen (1851-1930) priskribis la sintezon de la cinamataj esteroj pere de reakcio inter la benzaldehidoj kaj esteroj. La reakcio estas konata kiel Kondensiĝo de Claisen[14]. Ĝi same estas preparebla elde cinamataldehido kaj benzala klorido[15].
|
|
Literaturo
- The NIST WebBook
- Indiamart Arkivigite je 2017-04-18 per la retarkivo Wayback Machine
- Theodora.com
- Encyclopedia of Chemical Processing and Design: Volume 4 - Asphalt Emulsion ..., John J. McKetta Jr
- Introduction to Organic Laboratory Techniques: A Small Scale Approach, Donald L. Pavia
- Comprehensive Experimental Chemistry, V. K. Ahluwalia, Sudha Raghav
- Bulletin on Narcotics: Science in Drug Control - the Role of Laboratory and ... Arkivigite je 2017-04-18 per la retarkivo Wayback Machine, United Nations
- Allelochemicals: Biological Control of Plant Pathogens and Diseases, Inderjit, K.G. Mukerji
- ExpertsMind
- Nature
- Chemical Book
Kunrilataj kemiaĵoj

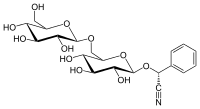
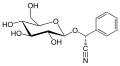
Prunazino

Mandelata acido 
Benzilidena klorido 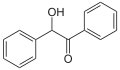
Benzoino 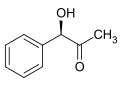
Fenila-acetila-karbinolo
Vidu ankaŭ
- Benzoata acido
- Tolueno
- Paul Ehrlich (1854-1915)
- Friedrich Wöhler (1800-1882)
- Justus von Liebig (1803-1873)
- Benzila alkoholo
- Pierre Jean Robiquet (1780-1840)
- Antoine Charlard (1796-1879)
- Stanislao Cannizzaro (1826-1910)
- Karl Wilhelm Rosenmund (1884-1965)
Referencoj
- ↑ Sigma Aldrich
- ↑ Benzaldehyde from Bitter Almond Oil
- ↑ Enyclopedia.com
- ↑ History of Shock Waves, Explosions and Impact: A Chronological and ..., Peter O. K. Krehl
- ↑ Classics in Spectroscopy, Stefan Berger,Dieter Sicker
- ↑ Method of producing benzaldehyde
- ↑ Organic Chemistry Portal
- ↑ Chemistryy John McMurry
- ↑ Youtube
- ↑ Youtube
- ↑ Organic Chemistry, Jonathan Clayden, Nick Greeves, Stuart Warren
- ↑ Name Reactions: A Collection of Detailed Reaction Mechanisms, Jie Jack Li
- ↑ Concise Encyclopedia Chemistry, Mary Eagleson
- ↑ Ullmann's Fine Chemicals, 3 Volume Set, Wiley-VCH
- ↑ Risk Management for Hazardous Chemicals, Volume 1, Jeffrey Wayne Vincoli



-Mandelonitrile-3D-balls.png.webp)
-Mandelic_acid_molecule_ball.png.webp)