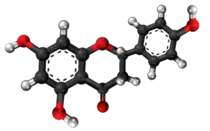
| Apigenino | ||
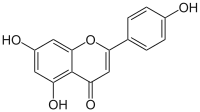 | ||
| Plata kemia strukturo de la Apigenino | ||
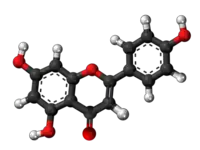 | ||
| Tridimensia kemia strukturo de la Apigenino | ||
 | ||
| Apigenino estas flaveca solidaĵo trovata en plantoj de la familio de la Matricaria chamomilla. | ||
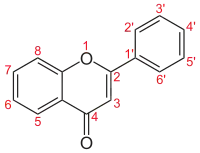 | ||
| Numerigo de la karbonaj strukturoj de la flavonoj. | ||
| Kemia formulo | ||
| CAS-numero-kodo | 520-36-5 | |
| ChemSpider kodo | 4444100 | |
| PubChem-kodo | 5280443 | |
| Merck Index | 15,717 | |
| Fizikaj proprecoj | ||
| Aspekto | kristalflava solidaĵo | |
| Molmaso | 270,240 g·mol−1 | |
| Denseco | 1,548g cm−3[1] | |
| Fandpunkto | 345 °C - 350 °C[2] | |
| Bolpunkto | 555,5 °C[3] | |
| Refrakta indico | 1,732 | |
| Ekflama temperaturo | 217,1 °C | |
| Acideco (pKa) | 6,53[4] | |
| Solvebleco | Akvo:0,156 g/L | |
| Mortiga dozo (LD50) | 4837 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Riskoj | R36/37/38 | |
| Sekureco | S26 S36 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P280, P305+351+338, P337+313[5] | |
(25 °C kaj 100 kPa) | ||
Apigenino, (4',5,7-trihidrokso-flavono) aŭ C15H10O5 estas kristalflava solidaĵo, vaste ĉeestanta en ordinaraj fruktoj, planto-derivitaj trinkaĵoj, kaj vegetaloj tiaj kiaj petroselo, celerio, tubercelerio, oranĝoj, cepoj, kamomilo, tritikaj ŝosoj, krom aliaj kondimentoj. Unu el la plej ordinaraj fontoj de apigenino konsumita kiel herba teo estas kamonmilo, preparata el sekaj floroj de la Matricaria chamomilla.
Ĉi tiu jara herbo-planto estas natura el Eŭropo kaj Okcidenta Azio, kiu estis naturaligita en Aŭstralio, Britio, kaj Usono. Infuzaĵoj de kamomilo enhavas maksimumajn koncentriĝojn de apigenino variantajn inter 0,8% kaj 1,2% kaj esencaj oleoj kiuj havas aromatajn gustojn kaj kolorajn proprecojn. Kamonilo estas konsumata sub la formo de teo po 1 miliono da taso tage.
Aliaj fontoj por la apigenino estas la trinkaĵoj tiaj kiaj la vino kaj biero produktitaj el naturaj ingrediencoj. Apigenino estas nature ĉeestanta kiel konstituaĵo de la ruĝa vino.[6] Apigenino estas potenca antitumorogena. Buŝadministrado de apigenino inhibas la kreskon de melanomoj.[7]
Sintezoj
Sintezo 1
- Preparado ekde la kempferolo per forigo de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Sintezo 2
- Preparado ekde la krizino per aldono de hidroksila grupo en la 4-a pozicio de la fenila grupo:
|
|
Sintezo 3
- Preparado ekde la kverketino per forigo de du hidroksilaj grupoj, unu en la 3-a pozicio de la benzipiranila grupo kaj alia en la 5-a pozicio de la fenila grupo:
|
|
Sintezo 4
- Preparado ekde la luteolino per forigo de hidroksila grupo en la 5-a pozicio de la fenila grupo:
|
|
Sintezo 5
- Preparado ekde la miriketino per forigo de tri hidroksilaj grupoj, du en la 3-a kaj 5-a pozicioj de la fenila grupo kaj tria en la 3-a pozicio de la benzipiranila grupo:
|
|
Sintezo 6
- Preparado ekde la naringenino per oksidado de la 2-a pozicio en la kromenonila grupo:
|
|
Sintezo 7
- Preparado ekde la fisetino per aldono de unu hidroksila grupo en la 5-a pozicio de la kromenonila grupo kaj forigo de du hidroksilaj grupoj, unu en la 3-a pozicio de la fenila grupo kaj alia en la 3-a pozicio de la kromenonila grupo:
|
|
Reakcioj
Reakcio 1
- Konvertado al kempferolo per aldono de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
|
|
Reakcio 2
- Konvertado al krizino per forigo de hidroksila grupo en la 4-a pozicio de la fenila grupo:
|
|
Reakcio 3
- Konvertado al kverketino per aldono de du hidroksilaj grupoj, unu en la 3-a pozicio de la benzipiranila grupo kaj alia en la 5-a pozicio de la fenila grupo:
|
|
Reakcio 4
- Konvertado al luteolino per aldono de hidroksila grupo en la 5-a pozicio de la fenila grupo:
|
|
Reakcio 5
- Konvertado al miriketino per aldono de tri hidroksilaj grupoj, du en la 3-a kaj 5-a pozicioj de la fenila grupo kaj tria en la 3-a pozicio de la benzipiranila grupo:
|
|
Reakcio 6
- Konvertado al naringenino per reduktado de la 2-a pozicio en la kromenonila grupo:
|
|
Reakcio 7
- Konvertado al "fisetino" per forigo de unu hidroksila grupo en la 5-a pozicio de la kromenonila grupo kaj aldono de du hidroksilaj grupoj, unu en la 3-a pozicio de la fenila grupo kaj alia en la 3-a pozicio de la kromenonila grupo:
|
|