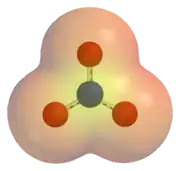
Elektrostatika potencialo en la nitrata jono (NO3−). Areoj kolorigitaj je ruĝa estas malpli energiaj ol areoj kolorigitaj je flava.
Anjono estas negative ŝargita jono. Ĉar la negative ŝargitaj jonoj dum la elektrolizo migras al la anodo (al pluspoluso), oni elektis por ili la nomon anjono. La anjonoj estiĝas el atomoj, molekuloj per akcepto de elektrono.
Ĉiu anjono - ekz. oksid- (O2−) aŭ sulfid-anjono (S2−) - povas kombiniĝi kun diversaj katjonoj, tiel estiĝas gravaj stabilaj kemiaj grupoj (ekz. oksidoj kaj sulfidoj). Oksidoj kaj sulfidoj formas multajn rokaĵojn kaj ercojn kaj tiel tre gravas en la mineralogio kaj metalurgio.
Ĉar ekzistas grandnombra kombinado de la jonoj, precipe okaze de organikaj kombinaĵoj, el inter la ĉ. miliono de anjonoj, ni listigas tie ĉi nur la unuatomajn anjonojn.
Gravaj unuatomaj anjonaj grupoj
Anjonoj de la 7-a ĉefgrupo
- Halogenido X−
Anjonoj de la 6-a ĉefgrupo
Anjonoj de la 5-a ĉefgrupo
- Nitrido N3−
- Fosfido P3−
- Arsenido As3−
- Antimonido Sb3−
- Bismutido Bi3−
Anjonoj de la 4-a ĉefgrupo
- Karbido C4−
- Silicido Si4−
- Germanido Ge4−
Anjonoj de la 3-a ĉefgrupo
- Borido Bx−
Vidu ankaŭ
Eksteraj ligiloj
- http://www.lenntech.com/Periodic-chart-elements/ionization-energy.htm Kemiaj elementoj listigitaj laŭ joniga energio
- http://science.nasa.gov/newhome/headlines/ast07sep99_1.htm Arkivigite je 2006-03-16 per la retarkivo Wayback Machine Plasmo
- https://web.archive.org/web/20060824033600/http://www.ed.gov.nl.ca/edu/k12/pub/pg2_periodic_table_ions.pdf Perioda tabelo de jonoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.