| Amonia valerato | ||
 | ||
| Plata kemia strukturo de la Amonia valerato | ||
 | ||
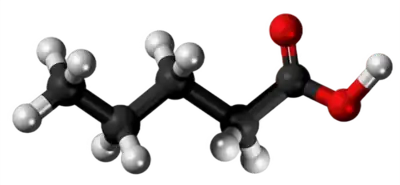
| Tridimensia kemia strukturo de la Amonia valerato | ||
| Kemia formulo | ||
| CAS-numero-kodo | 42739-38-8 | |
| ChemSpider kodo | 142697 | |
| PubChem-kodo | 162525 | |
| Fizikaj proprecoj | ||
| Aspekto | blankaj higroskopaj kristaloj | |
| Molmaso | 119,1622 g·mol-1 | |
| Denseco | 1,0801g cm−3 | |
| Fandpunkto | 108°C[1] | |
| Bolpunkto | 185,3°C[2] | |
| Refrakta indico | 1,4180 | |
| Solvebleco | Akvo:Tute solvebla | |
| Sekurecaj Indikoj | ||
| Riskoj | R36 R37 R38 | |
| Sekureco | S26 S36 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319 | |
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P280, P303+361+353, P370+378, P403+235, P501 | |
(25 °C kaj 100 kPa) | ||
Amonia valerato aŭ C5H13NO2 estas amoniaka salo de la valerata acido, blankaj malbonodoraj kristaloj tre solveblaj en akvo, alkoholo, esencaj oleoj kaj etero. Ĝi uzatas en farmakologio, en la nutroindustrio, kiel trankviligilo, kiu ĉefe agas sur la nazaj kaj psikaj refleksoj. Kiam varmigita kun fosfora kvinoksido ĝi produktas valero-nitrilon. Ĉi-salo formiĝas dum putriĝo de organikaj substancoj, kaj ofte trovatas en la ŝimiganta fromaĝo. Unu el ĝiaj unuaj uzoj estis kiel sedativo kun trankviligaj proprecoj kontraŭ nervo-malsanoj.[3]
Sintezoj
Sintezo 1
- Preparado per agado de valerata acido kaj amonia hidroksido:
|
|
Sintezo 2
- Preparado per traktado de valerata anhidrido kaj amonia hidroksido:
|
|
Sintezo 3
- Preparado per reakcio de propanoata acido kaj amonia karbonato:
|
|
Sintezo 4
- Preparado per traktado de amoniako, etanolo kaj metila valerato:
|
|
Sintezo 5
- Preparado per interagado de metila valerato kaj amonia formiato:
|
|
Sintezo 6
- Preparado per acida transesterigo inter valerata acido kaj amonia benzoato:
|
|
Sintezo 7
- Preparado per alkohola transesterigo inter etila valerato kaj amonia hidroksido:
|
|
Reakcioj
Reakcio 1
- Hidrolizo de la amonia piruvato:
|
|
Reakcio 2
- Reakcio kun sulfata acido:
|
|
Reakcio 3
- Reakcio per acida transesterigo kun formiata acido formiata acido:
|
|
Reakcio 4
- Reakcio per alkohola transesterigo kun metila alkoholo metila alkoholo:
|
|
Reakcio 5
- Reduktigo de la amonia valerato:
|
|
Reakcio 6
- Reakcio kun HNO3:
|
|
Reakcio 7
- Reakcio kun HCl:
|
|
Reakcio 8
- Senhidratigo de la amonia valerato en ĉeesto de fosfora kvinoksido:[4]
|
|
Vidu ankaŭ
Literaturo
- Drugs & Supplements
- Handbook of Inorganic Compounds
- CRC Handbook of Chemistry and Physics
- The Pharmaceutical Era
- A Dictionary of Chemistry and the Allied Branches of Other Sciences
- Principles of Organic Chemistry
- Hawley's Condensed Chemical Dictionary
- Concise Dictionary of Biomedicine and Molecular Biology
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.