| Amonia propanato | |||
 | |||
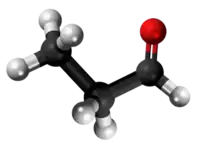
| Plata kemia strukturo de la Amonia propionato | |||
 | |||
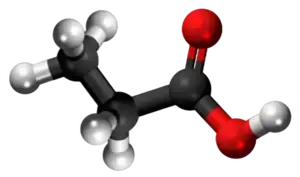
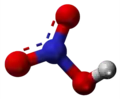
| Tridimensia kemia strukturo de la Amonia propionato | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 17496-08-1 | ||
| ChemSpider kodo | 78604 | ||
| PubChem-kodo | 173965 | ||
| Fizikaj proprecoj | |||
| Aspekto | blankaj kristaloj | ||
| Molmaso | 91,10906 g·mol-1[1] | ||
| Denseco | 1,050g cm−3 | ||
| Fandpunkto | 45 °C[2] | ||
| Bolpunkto | 141,7 °C | ||
| Ekflama temperaturo | 57,70 °C | ||
| Solvebleco | Akvo:Tute solvebla | ||
| Mortiga dozo (LD50) | 662 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R10 R20 | ||
| Sekureco | S24 S25 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P321, P332+313, P337+313, P362, P403+233, P405, P501[3] | ||
(25 °C kaj 100 kPa) | |||
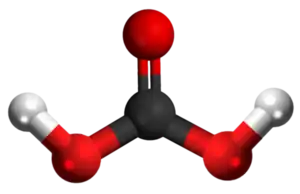
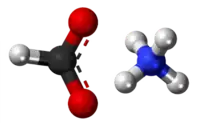
Amonia propionato aŭ C3H9NO2 estas kemia organika kombinaĵo, blankaj kristaloj rezultantaj per interagado de la propionata acido kaj amonia hidroksido. Ĝi estas tute solvebla en akvo, acetata acido kaj etanolo. Amonia propionato uzatas kiel nutrokonservanto kaj estas alte higroskopa. Ĝi estas koroda al metaloj, kaŭzas iriton al haŭto, okuloj kaj spirsistemo. Per malkomponado ĝi eligas toksajn kaj iritajn gasojn.
Sintezoj
Sintezo 1
- Preparado per agado de propionata acido kaj amonia hidroksido:
|
|
Sintezo 2
- Preparado per traktado de propionata anhidrido kaj amonia hidroksido:
|
|
Sintezo 3
- Preparado per reakcio de propanata acido kaj amonia karbonato:
|
|
Sintezo 4
- Preparado per traktado de amoniako, etanolo kaj metila propionato:
|
|
Sintezo 5
- Preparado per interagado de fenetila propionato kaj amonia formiato:
|
|
Sintezo 6
- Preparado per acida transesterigo inter propionata acido kaj amonia benzoato:
|
|
Sintezo 7
- Preparado per alkohola transesterigo inter alila propionato kaj amonia hidroksido:
|
|
Reakcioj
Reakcio 1
- Hidrolizo de la amonia propionato:
|
|
Reakcio 2
- Reakcio kun sulfata acido:
|
|
Reakcio 3
- Reakcio per acida transesterigo kun formiata acido:
|
|
Reakcio 4
- Reakcio per alkohola transesterigo kun fenetila alkoholo:
|
|
Reakcio 5
- Reduktigo de la amonia propionato:
|
|
Reakcio 6
- Reakcio kun HNO3:
|
|
Reakcio 7
- Reakcio kun HCl:
|
|
Literaturo
- GuideChem
- Royal Society of Chemistry
- University of Wisconsin-Madison
- International critical tables of numerical data, physics, chemistry and ...
- Topics in Dental Biochemistry
- Research Report from the Michigan State University
- Barley
- rganic Chemistry: An Acid-Base Approach
- European Food Safety Authority
Referencoj
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.