| Amonia permanganato | |||||
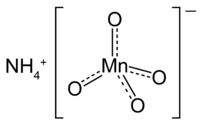 | |||||
| Kemia strukturo | |||||
| Kemia formulo |
| ||||
| CAS-numero-kodo | 13446-10-1 | ||||
| ChemSpider kodo | 55512 | ||||
| PubChem-kodo | 61604 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | rombaj nadlosimilaj kristaloj aŭ polvo kun riĉa violbruna aŭ malhelpurpura metala brilo, fariĝas griza dum stokado; magenta–rozo en solvaĵo, kristala strukturo, ortoromba | ||||
| Molmaso | 136.974 g/mol | ||||
| Smiles |
| ||||
| Denseco | g/cm3, solido g/cm3 (likva)
| ||||
| Fandopunkto | malkomponiĝas | ||||
| Solvebleco:Akvo | 8.0 g/100 ml ĉe 15 °C | ||||
| Ekflama temperaturo | 30 °C | ||||
| Sekurecaj Indikoj | |||||
| Risko | |||||
| Sekureco | |||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H272, H302, H410 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P220, P221, P264, P270, P273, P280, P301, P330, P391, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Amonia permanganato aŭ NH4MnO4 estas kemia kombinaĵo rezultanta el la reakcio inter la permanganata acido[1] kaj amonia hidroksido[2]. Ĝi estas akvosolvebla kaj forta oksidanto, pro la ĉeesto de la permanganata anjono aŭ MnO4−. Ĝi estas modere forta eksplodaĵo pro la kombiniĝo de la oksidiga permanganatjono kaj la redukta katjono. Seka amonia permanganato povas eksplodi pro varmo, ŝoko aŭ frotado, kaj ĝi eksplodeblas kiam temperaturo superas al 60 °C (140 ℉).
Permanganato de amonio malkomponiĝas spontanee al "mangana duoksido", nitrogeno kaj akvo[3].
Historio
Amonia permanganato estis unue preparita de Eilhard Mitscherlich, en 1824, per reakcio inter la arĝenta permanganato kaj egala molkvanto da amonia klorido, filtrante la arĝentan kloridon kaj vaporigante la akvon.
Ĝi same estas preparebla laŭ simila maniero kiam "baria permanganato" reakcias kun amonia sulfato, laŭ la ekvacio:
Amonia permanganato malkomponiĝas malrapide kiam stokita eĉ ĉe normalaj temperaturoj. Specimenoj stokitaj dum tri monatoj kaj kun 96% da pureco, post 6 monatoj ĝi fariĝas jodokolora (bruna aŭ viola) kaj posedas fortan odoron je nitrogenoksidoj. Ĝi eligas toksajn fumojn kiam malkomponita per varmigo.
Literaturo
- Quaternary Ammonium Salts: Their Use in Phase-Transfer Catalysis, R. Alan Jones
- Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens ..., Volume 1
- Handbook of Emergency Chemical Management, David R. Quigley
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances, Pradyot Patnaik
- Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens ..., Volume 1
| ||||||
Referencoj
- ↑ PIV
- ↑ Emergency Characterization of Unknown Materials, Rick Houghton
- ↑ Reactions in the Solid State, Michael E. Brown, D. Dollimore, A.K. Galwey







