| Akroleino | |||||
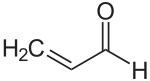 | |||||
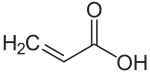
| Plata kemia strukturo de la Akroleino | |||||
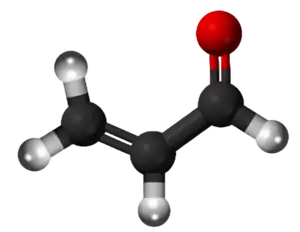 | |||||
| Tridimensia strukturo de la Akroleino | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 107-02-8 | ||||
| ChemSpider kodo | 7559 | ||||
| PubChem-kodo | 7847 | ||||
| Merck Index | 15,119 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora ĝis flava likvaĵo kun irita odoro. | ||||
| Molmaso | 56.06 g·mol-1 | ||||
| Denseco | 0.839 g cm−3 | ||||
| Fandpunkto | −88 °C | ||||
| Bolpunkto | 53 °C | ||||
| Refrakta indico | 1,4017 | ||||
| Ekflama temperaturo | −26 °C | ||||
| Memsparka temperaturo | 278 °C | ||||
| Solvebleco | Akvo:
| ||||
| Mortiga dozo (LD50) | 46 g/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Risko | R11 R24/25 R26 R34 R50 | ||||
| Sekureco | S23 S26 S28 S36/37/39 S45 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H225, H300+330, H311, H314, H410 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P280, P301+310, P304+340, P305+351+338, P370+378 | ||||
Akroleino estas la plej simpla nesaturita aldehido, senkolora likvaĵo kun akra malagrabla odoro. La odoro je bruligita graso, kiam kuiroleo varmiĝas ĝis ties fumpunkto, kaŭzatas de la glicerolo kiam la bruliga graso transformiĝas en akroleino. Industrie ĝi estas produktata el la propileno kaj ĉefe uzatas kiel biocido kaj kemia kontrubloko pro kreado de aliaj kemiaj komponaĵoj, tia kia la aminoacido metionino.
Akroleino estas alte toksa brulema substanco kun ekstreme forta larmigaj proprecoj. Sub meditemperaturo, akroleino estas likvaĵo kun iom da volatileco kaj brulemeco iom simila al tiu de la acetono, kaj rapide transformiĝas en vaporo kiam hejtata. Akroleino estas komerce produktita ekde 1938.
En 1995, la tutmonda produktado de akroleino atingis 113 mil tunojn ĉiujare. Pro ĝia antimikroba aktiveco, akroleino uzatas kiel agento por kontrolado de mikrobo-kreskado en manĝo-industrio, per tio kontrolante la nivelojn de korodo kaj ŝtopo en la produktada procezoj. Etaj kvantoj da akroleino formiĝas kaj disiriĝas tra la atmosfero kiam arboj, tabako, plantoj, benzino kaj oleo brulas. Akroleino uzatas kiel pesticido en la kontrolo de pestoj, trudherboj, bakterio kaj moluskoj.
La urba atmosfero enhavas averaĝan koncentriĝon je 0.006 ppm de akroleino. William Ramsay sugestis al la Brita Ministerio pri Milito ke la akroleino estus uzata kontraŭ milit-malamikoj[1] kaj ĝi fakte estis uzata kiel larmiga gaso.
Sintezoj
- Akroleino povas prepariĝi per parta oksidado de propeno aŭ per reakcio de la acetaldehido kun formaldehido, konata kiel aldola kondensiĝo. Ĉi-kondensiĝo estis disvolvita de la entrepreno Degussa en 1930, sed ĝia produktado komencis nur en 1942:[2].

- Ĉi-metodo estis nuntempe anstataŭata per la Metodo Sohio:


- Akroleino estas preparebla per varma senhidratigo de la glicerolo en ĉeesto de sulfata acido:
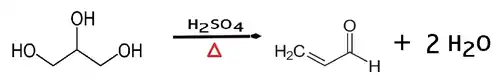
Per varmigado de la kuiroleo la glicerolo malkomponiĝas per akvo kaj akroleino. Pro tio oni sentas okulardon dum fritadoprocezoj.
Reakcioj
- Akroleino, estante nesaturita aldehido, elmontras reakciajn karakterizaĵojn kaj de olefinoj kaj de la aldehidoj. Tiamaniere ke la akroleinoj estigas acetalojn:
- Ĝia aldehida grupo facile oksidiĝas al karboksilo:
- Per hidrogenigo ĝi reduktiĝas al alkoholo:
- La karbonila grupo de la akroleino konjugas kun la duobla ligilo, kio rezultas en ĝia alta reakciemo antaŭ nukleofilaĵoj, kun aldono okazanta en la β-karbonatomo:
- Halogenidoj estas aneksitaj al la akroleino pro la duobla ligilo por formi duhalogenidan derivaĵon, kiu poste rompas la hidrogenan halogenidon por formado de α-halogenidakroleino:
- Pro la ĉeesto de elektron-retiriĝanta aldehida grupo konjugata al la duobla ligilo, la akroleino estas duenofilo kaj reakcias kun duenoj por formi cikloaldonajn produktojn, konatajn kiel Reakcio de Diels-Ader:

Literaturo
Kunrilataj kemiaĵoj

Glutaraldehido