| Adipata acido | ||
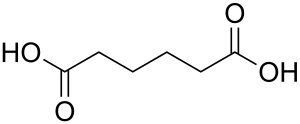 | ||
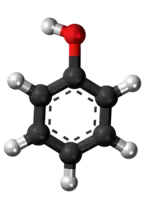
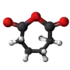
| Plata kemia strukturo de la Adipata acido | ||
 | ||
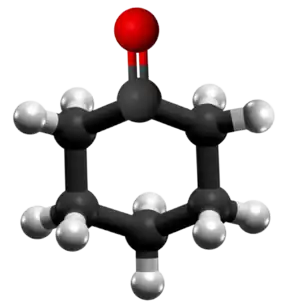
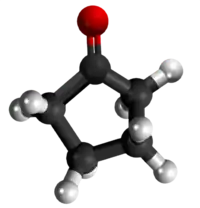
| Tridimensia kemia strukturo de la Adipata acido | ||
 | ||
| Adipata acido estas nature trovata en la Beta vulgaris | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | 124-04-9 | |
| ChemSpider kodo | 191 | |
| PubChem-kodo | 196 | |
| Fizikaj proprecoj | ||
| Aspekto | blankaj kristaloj | |
| Molmaso | 146,142 g·mol-1 | |
| Denseco | 1,360g cm−3 | |
| Fandpunkto | 151 °C[1] | |
| Bolpunkto | 337 °C | |
| Ekflama temperaturo | 196 °C | |
| Memsparka temperaturo | 422 °C | |
| Acideco (pKa) | 4,43 | |
| Solvebleco | Akvo:14,4 g/L [2] | |
| Mortiga dozo (LD50) | 3600 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Riskoj | R22 R36 | |
| Sekureco | S02 S24/25 S36 S37 S45 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H319, H335, H372, H402 | |
| GHS Deklaroj pri antaŭgardoj | P264, P280, P305+351+338, P337+313[3] | |
(25 °C kaj 100 kPa) | ||
Adipata acido aŭ C6H10O4 estas kemia kombinaĵo, apartenanta al la funkcia grupo de la organikaj acidoj uzataj kiel analiza reakciaĵo en kemiaj sintezoj. Adipata acido estas blanka kristalo, uzata kiel gustigagento kaj odorigagento en la nutrondustrio kaj en la fabrikado de kosmetikaĵoj kaj farmaciaĵoj.
Sintezoj
Sintezo 1
- Preparado per oksidado de la cikloheksanolo:
|
|
Sintezo 2
- Preparado per hidrogenigo de la adipaldehido
|
|
Sintezo 3
- Preparado per sapigo de la adipatoila klorido:
|
|
Sintezo 4
- Preparado per hidrogenigo de la cikloheksanono:
|
|
Sintezo 5
- Preparado per sapigo de la adipaldehido, sekvata per reakcio de la natria adipato kun sulfata acido:
|
|
Sintezo 6
- Preparado per hidratigo de la adipo-nitrilo:
|
|
Sintezo 7
- Preparado de la adipata acido per hidrogenigo de la fenolo, sekvata per traktado de la rezultanta cikloheksanono kun nitrita acido:[4]
|
|
Reakcioj
Reakcio 1
- Per varmigo adipata acido produktas ciklopentanonon kaj karbonan duoksidon:
|
|
Reakcio 2
- Alkohola esterigo de la adipata acido:
|
|
Reakcio 3
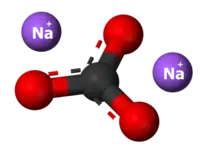
- Salformado per reakcio kun natria hidroksido:
|
|
Reakcio 4
- Reakcio kun karbonatoj:
|
|
Reakcio 5
- Reakcio kun sulfurila klorido:
|
|
Reakcio 6
- Reakcio kun tionila klorido:
|
|
Reakcio 7
- Senhidratigo kun formado de la adipata anhidrido en ĉeesto de fosfora kvinoksido:
|
|
Literaturo
Referencoj
| ||||||
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.