| Acetata acido | |||
 | |||
| Kemia strukturo de la acetata acido | |||
 | |||
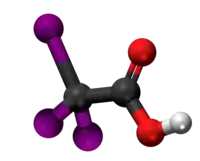
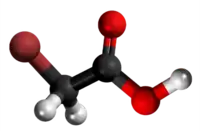
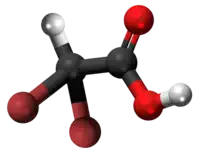
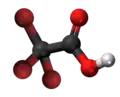
| 3D Kemia strukturo de la acetata acido | |||
| Alternativa(j) Nomo(j) | |||
| Etanata acido Acetum[1] Acidum aceticum | |||
| Kemia formulo | H3CCOOH | ||
| PubChem-kodo | 176 | ||
| ChemSpider kodo | 171 | ||
| CAS-numero-kodo | 64-19-7 | ||
| Karakterizaĵoj | |||
| Acideco (pKa) | 4.76 | ||
| Molmaso | 60.05 g·mol-1 | ||
| Aspekto | senkolora likvaĵo | ||
| Denseco | 1.049 (48% akva solvaĵo) g/mL (liquid) | ||
| Fandopunkto | 16 °C; 61 ℉; 289 K | ||
| Bolpunkto | 118 °C; 244 ℉; 391 K | ||
| Refrakta indico | 1,3710 | ||
| Akva solvebleco | Tute miksebla | ||
| pKa | -1,4 | ||
| Viskozeco | 1.22 mPa s | ||
| Sekurecaj Indikoj | |||
| Riskoj | R10 R35 | ||
| Sekureco | (S1/2) S23 S26 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero |
| ||
| GHS etikedigo de kemiaĵoj | |||
| GHS Signalvorto | Danĝera | ||
| GHS Damaĝo-piktogramo |
| ||
| GHS Deklaroj pri damaĝoj | H226, H314 | ||
| GHS Deklaroj pri antaŭgardoj | P280, P305+351+338, P310 | ||
Aceta acido, sisteme ankaŭ nomata Etanata acido, estas karboksilata acido kun kemia struktura formulo CH3-COOH. En Normaj kondiĉoj pri temperaturo kaj premo ĝi estas senkolora likvaĵo kun pikanta odoro. Je normaj atmosfera premo senakva aceta acido degelas je temperaturo 16.7 °C kaj bolas je temperaturo 118.1 °C. En tiuj kondiĉoj la acetata acido estas nomata glacia acetata acido kaj ĝi estas akragusta kaj iritaflara. Krom la produktado de hejma vinagro, ĝi estas ĉefe uzata kiel antaŭilo de la povinila acetato[2] kaj celuloza acetato. Kvankam ĝi estas klasifikata kiel malforta acido, koncentrita acetata acido estas koroda kaj atakeblas la haŭton.

Acetata acido estas la dua plej simpla karboksilata acido (post la formiata acido) kaj estas grava kemia reakcianto kaj industria kemiaĵo, ĉefe uzata en la produktado de celuloza acetato por fotografiaj filmoj kaj polivinila acetato por la produktado de lignogluo, samkiel sintezan fibroj kaj teksaĵoj. Hejme, diluita acetata acido ofte uzatas kiel malkrustiga aganto. En nutroindustrio, la acetata acido estas identigata sub la kodo E260 kiu indikas la acidecoregulantojn kaj kondimentojn. Kiel aldona nutraĵo ĝi estas aprobita de multaj landoj, inkluzive de Kanado, Eŭropa Unio, Usono, Aŭstralio kaj Nov-Zelando. La tutmonda konsumo de acetata acido estas ĉirkaŭ 6.5 milionoj da tunoj jare (Mt/j), el kiuj 1.5 Mt/j estas recikligitaj kaj la resto estas fabrikita el petrokemia krudmaterialo. Kiel kemia reakcianto, biologiaj fontoj por acetata acido estas alte interesaj, tamen entute ne estas konkuraj. Vinagro estas acetata acido diluita, ofte produktita pere de fermentado kun sekva oksidado de etanolo.
Nomenklaturo
La ordinara nomo acetata acido estas la plej preferata kaj uzata nomo de IUTAK. La sistema nomigo etanata acido, kiu estas valida nomo, estas konstruita laŭ la anstataŭa nomenklaturo. La vortoj acetata acido devenas de la latina "acetum" kiu signifas vinagro, kaj rilatas al la vorto acido mem.
Glacia acetata acido estas la nomo por anhidra acetata acido. Simile al la germana nomo, Eisessig (glacia vinagro), la nomo devenas de kristaloj glacisimilaj formantaj sub la meditemperaturo je 16.6 °C (61.9 ℉) . La ĉeesto de 0.1% de akvo malaltigas ties fandopunkton en 0.2 °C.
Kutima ĉefliterigo de acetata acido estas AcOH, kie Ac indikas la ĉeeston de iu acetila grupo aŭ CH3−CO−. La acetatoj estas konataj laŭ la identigoj CH3−COO− aŭ AcO−. La ĉefliteroj Ac ne devas konfuziĝi kun la mallongigo por la kemia elemento Aktinio. En la kunteksto de la acido-bazaj reakcioj, la mallongigo HAc kelkfoje estas uzata kie Ac identigas la jonon acetatan. Acetato estas la jono rezultanta en perdo de iu protono H+ el la acetata acido. La nomo acetato ankaŭ povas signifi la salon entenantan ĉi anjonon aŭ la esteron el la acetata acido.
Historio
Vinagro estas konata ekde la komenco de la civilizacio kiel rezulto de submetiĝo de biero kaj vino al la aero, ĉar la bakterioj produktantaj acetatan acidon ĉeestas ĉies. La uzo de acetata acido en alkemio retroiras al la 3-a jarcento a. K., kiam la greka filozofo Teofrasto priskribis kiel la vinagro aktivas surmetale por produkti pigmentojn utilajn en la artoj, inkluzive de blanka plumbo[3] aŭ plumba karbonato kaj verdigro[4], iu miksaĵo de kupraj saloj aldone de kupraj acetatoj[5]. La anktivaj romanoj boladis acidiĝinta vino por produkti alte dolĉan siropon nomitan "sapa"[6]. La sapaj siropoj kiuj estis produktitaj en plumbaj potoj estis riĉaj je plumba acetato[7], iu dolĉa substanco ankaŭ konata kiel plumba sukero aŭ Saturna sukero, kontribuanta por la plumba veneniĝo inter la roma aristokrataro.
En la 16-a jarcento, la germana alkemiisto Andreo Libavo priskribris la produktadon de ketono ekde la seka distilado de la plumba acetato, konata kiel ketona malkarboksiliĝo[8]. La ĉeesto de akvo en vinagro aldonas profundan efekton sur la proprecoj de la acetata acido, tiom ke, dum jarcentoj la kemiistoj kredis ke la glacia acetata acido kaj la acideco trovata en la vinagro estis du malsimilaj substancoj. La franca kemiisto Pierre-Auguste Adet (1767-1848) pruvis ke ili estas identaj.
En 1845, la germana kemiisto Hermann Kolbe (1818-1884) sintezis unuafoje acetatan acidon elde neorganikaj komponaĵoj. Ĉi sinsekva reakcio konsistis je kloraldono de karbona dusulfido al karbona kvarklorido[9], sekvata de pirolizo al kvarkloroetileno[10] and akva kloraldono al trikoloroacetata acido[11], finante per elektrolita reduktiĝo al acetata acido.
Ĉirkaŭ 1910, la plejmulto el la glacia acetata acido produktiĝis el "piroliza likvoro" estigita de lignodistilado. La acetata acido estis izolita pere de traktado kun kalcia hidroksido, ankaŭ konata kiel estingiĝinta kalkakvo aŭ kalkolakto, kaj la rezultanta kalcia acetato estis plue acidigita kun sulfata acido por rekuperado de la acetata acido. Tiuepoke, Germanio produktis 10 mil tunojn da glacia acetata acido, kie 30% el ĝi estis uzita por la produktado de indiga tinkturo.
Ĉar metanolo kaj karbona unuoksido estas altvaloraj krudmaterialoj, la metanola malkarboksilado longatempe estis altira procezo por produktado de acetata acido. Henri Dreyfus, el la kompanio "British Celanese"[12], instalis produktejon por metanola malkarbosilado ĉirkaŭ 1925. Tamen, la manko de praktikaj materialoj kiuj povus enteni la miksaĵon kun koroda reakcio en altaj premoj je 200 atm aŭ pli, malestimulis la komercadon de ĝiaj procezoj. La unua komerca procezo por metanola malkarbosilado, kiu tiam uzis kobalton kiel katalizilo, estis disvolvita de la germana kemia kompanio BASF, en 1963. En 1968, iu rodiobaza katalizilo estis malkovrita kaj tio eblis la efikan produktadon je malalta premo preskaŭ sen flankproduktoj. En 1970, la kemia fabrikanto Monsanto Company konstruis la unuan aparataron uzantan ĉi-katalizilon, kaj la metanola malkarbosilado per rodia katalizilo fariĝis la plej grava metodo por produktado de acetata acido. En la jardeko 1990, la kemikompanio BP Chemicals komercis la katalizilon "Cativa"[13], surbaze de iridio kiu agas plej efike. Ĉi-katalizilo estas malpli damaĝa al vivmedio kaj pli efika, krom larĝe superi al la procezo de Monsanto.
Halogenidaj derivaĵoj de acetata acido
Komponaĵoj
Referencoj
- ↑ British Pharmacopoeia
- ↑ PubChem
- ↑ PubChem
- ↑ European Women and Preindustrial Craft Daryl M. Hafter
- ↑ ChemSpieder
- ↑ Balsamic Vinegars: Tradition, Technology, Trade, Paolo Giudici, Federico Lemmetti, Stefano Mazza
- ↑ PubChem
- ↑ Advances in Catalysis.
- ↑ PubChem
- ↑ ChemSpider
- ↑ PubChem
- ↑ International Encyclopedia of Comparative Law, Viktor Knapp
- ↑ Industrial Organic Chemicals, Harold A. Wittcoff, Bryan G. Reuben, Jeffery S. Plotkin
Vidu ankaŭ
- Verdigro
- Vinagro
- Grasacido
- Acetila Koenzimo A
- Etanolo
- Camille Dreyfus (1787-1956)
- Henri Dreyfus (1882-1944)
- Hermann Kolbe (1818-1884)
- Andreas Libavius (1555-1616)