Zinkiodid
Zinkiodid ist eine chemische Verbindung von Zink und Iod aus der Gruppe der Halogenide. Das weiße hygroskopische Pulver nimmt in feuchter Luft Wasser auf und zerfließt (geht in Lösung). An Luft reagiert es unter Freisetzung von Iod, so dass sich die Verbindung bzw. deren Lösung gelblich färbt.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Zn2+ _ I− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinkiodid | ||||||||||||||||||
| Andere Namen |
Zink(II)-iodid | ||||||||||||||||||
| Verhältnisformel | ZnI2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser, hygroskopischer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 319,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,74 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
625 °C[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Gewonnen werden kann Zinkiodid durch Reaktion von Zink mit Iod unter Wasserzusatz.[4]
Eigenschaften
Zink(II)-iodid ist ein farbloser Feststoff, der löslich in Wasser, Ethanol, Ether, Aceton und Dioxan ist. Unterhalb von 0 °C kristallisiert aus der Lösung das Dihydrat aus. Beim Erhitzen an Luft erfolgt Zersetzung.[4]
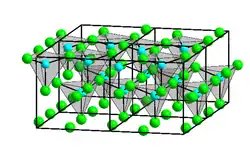
Die kristalline Struktur von Zink(II)-iodid ist ungewöhnlich. Sie bildet wie die anderen Zinkhalogenide (mit Ausnahme von Zinkfluorid) keine ionische Bindung, sondern eine kovalente Bindung aus und ist damit kein Salz im eigentlichen Sinne.[5] Während die Zinkatome wie in Zinkchlorid tetraedisch koordiniert sind, bilden im Unterschied zu diesem jeweils vier an drei Ecken verbundene Tetraeder ein „Super-Tetraeder“ der Zusammensetzung (Zn4I10) und so eine entsprechende dreidimensionale Struktur.[6] Diese „Super-Tetraeder“ ähneln der Struktur von Phosphorpentoxid P4O10.[6] Molekulares Zink(II)-iodid ist laut VSEPR-Modell linear und hat einen Zn–I-Abstand von 238 pm.[6]
Verwendung
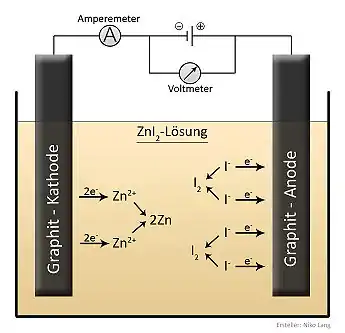
Da die Verbindung Röntgenstrahlung gut absorbiert, wird sie häufig als Kontrastmittel in der Röntgendiagnostik von Werkstoffen (Eindringen in beschädigtes Material) eingesetzt. Weiterhin wird sie als Schulchemikalie bei Versuchen zur Elektrolyse eingesetzt.[7]
Durch diese Ausnutzung dieser Reaktion und ihrer Umkehrung ist auch der Aufbau eines Zink-Iod-Akkumulators möglich.[8]
Einzelnachweise
- Datenblatt Zinkiodid bei Merck, abgerufen am 25. April 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-100.
- Eintrag zu Zinkiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1025.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- A. F. Wells: Structural Inorganic Chemistry. 5th edition, Oxford Science Publications, 1984, ISBN 0-19-855370-6.
- Elektrolyse von Zinkiodid (PDF; 217 kB).
- Zink-Iod-Element (Poenitz-net) (PDF; 13 kB).